beta-Sitosterol
| β-Sitosterol | |
|---|---|
 | |
 | |
Estigmast-5-en-3β-ol | |
Outros nomes 22,23-Dihidroestigmasterol, β-sitosterina | |
| Identificadores | |
| Número CAS | 83-46-5 |
| PubChem | 222284 |
| ChemSpider | 192962 |
| UNII | S347WMO6M4 |
| ChEBI | CHEBI:27693 |
| ChEMBL | CHEMBL221542 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C29H50O |
| Masa molar | 414,71 g mol−1 |
| Punto de fusión | 136–140 °C; 277–284 °F; 409–413 K |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O β-sitosterol (beta-sitosterol) é un dos varios fitosterois (esterois de plantas) con estrutura química similar á do colesterol. É un po branco ceroso cun cheiro característico e un dos compoñentes do aditivo alimentario E499. Os fitosterois son hidrófobos e solubles en alcohois.
Distribución natural e en alimentos
[editar | editar a fonte]O β-sitosterol está amplamente distribuído no reino das plantas e encóntrase en aceites vexetais, noces, aguacates e comidas preparadas, como nos aderezos de ensaladas.[1]
Investigación en humanos
[editar | editar a fonte]O β-sitosterol está sendo estudado polo seu potencial de reducir a hiperplasia prostática benigna[2][3] e os niveis sanguíneos de colesterol.[4]
Trastorno xenético
[editar | editar a fonte]Aínda que os esterois vexetais son xeralmente beneficiosos, existe un raro trastorno xenetico autosómico, a fitosterolemia, que causa unha sobreabsorción de fitosterois.[5]
Precursor do esteroide anabólico boldenona
[editar | editar a fonte]O β-sitosterol é un esteroide precursor do esteroide anabólico boldenona. O undecilenato de boldenona utilízase comnmente en veterinaria para inducir o crecemento do gando vacún, mais tamén é un dos esteroides anabólicos prohibidos máis utilizados por deportistas. Isto fixo sospeitar que algúns atletas que deron positivo en undecilenato de boldenona non se doparon coa hormona propiamente dita senón que comeron alimentos ricos en β-sitosterol.[6][7][8]
Química
[editar | editar a fonte]Enxeñaría química
[editar | editar a fonte]O uso de sitosterol como intermediario químico estivo durante moitos anos limitado debido á que carecía dun punto químico por onde atacar a súa cadea lateral, o que permitiría eliminar dita cadea. Despois de amplos esforzos realizados por moitos laboratorios conseguiuse finalmente descubrir un microbio do grupo das pseudomonas que podía efectuar eficientemente esta transformación. A fermentación dixire toda a cadea lateral alifática no carbono 17 rendendo unha mestura de produtos 17-ceto incluíndo a deshidroepiandrosterona.[9]
Síntese
[editar | editar a fonte]Non se conseguiu aínda a síntese total de β-sitosterol. Porén, o β-sitosterol foi sintetizado do estigmasterol (1 na imaxe), para o cal cómpre unha hidroxenación específica da cadea lateral do estigmasterol.
O primeiro paso da síntese é formar tosilato de estigmasterol (2) a partir de estigmasterol (1) (95% de pureza) usando p-TsCl, DMAP, e piridina (rendemento do 90%). O tosilato (2) sofre despois solvólise ao ser tratado con piridina e MeOH anhidro para dar unha proporción de 5:1 de i-estigmasterol metil éter (3, cun 74% de rendemento) respecto a estigmasterol metil éter (4), que é seguidamente retirado por cromatografía. O paso de hidroxenación dunha síntese previamente proposta comprende o uso do catalizador Pd/C e o solvente etil acetato. Porén, debido á isomerización durante a hidrólise, foron tamén probados outros catalizadores, como o PtO2, e solventes, como o etanol. Observáronse poucos cambios co uso dun catalizador diferente. Porén, o etanol impedía a isomerización e a formación de impurezas non identificadas para dar o composto 5. O último paso da síntese é a desprotección do dobre enlace do anel β de 5 con p-TsOH, dioxano acuoso e calor (80 °C) para render β-sitosterol (6). O rendemento acumulativo dos dous pasos finais foi do 55% e o rendemento total da síntese foi do 37%.[10]
Biosíntese
[editar | editar a fonte]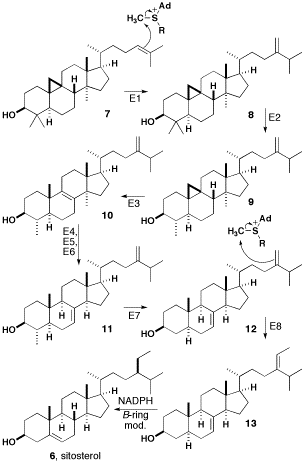
A regulación da biosíntese de esterois e algúns lípidos específicos ocorre durante a bioxénese de membranas.[11] Por medio de padróns de etiquetado 13C, determinouse que na formación de β-sitosterol están implicadas tanto a vía do mevalonato coma a da desoxixilulosa.[12] O mecanismo preciso da formación de β-sitosterol varía de segundo o organismo, pero observouse que xeralmente procede do cicloartenol.[13]
A biosíntese de cicloartenol empeza cando unha molécula de isopentenil difosfato (IPP) e dúas moléculas de dimetilalil difosfato (DMAPP) forman farnesil difosfato (FPP). Dúas moléculas de FPP únense despois cola con cola rendendo escualeno, un triterpeno. O escualeno, por medio dunha reacción de ciclación co 2,3-oxidoescualeno 6 como intermediario forma cicloartenol.
O dobre enlace do cicloartenol (composto 7 no diagrama) é metilado polo encima SAM para dar lugar a un carbocatión que sofre un cambio de hidruro e perde un protón para render un composto cunha cadea lateral metileno. Ambos os pasos son catalizados pola esterol C-24 metiltransferase (paso E1 do diagrama). O composto 8 é despois catalizado pola esterol C-4 desmetilase (E2) e perde un grupo metilo para producir cicloeucalenol (9). Seguidamente, o anel ciclopropano abre e a cicloeucalenol cicloisomerase (E3) forma o 10. O composto 10 perde un grupo metilo e sofre unha isomerización alílica orixinando gramisterol (11). Este paso é catalizado pola esterol C-14 desmetilase (E4), a esterol Δ14-redutase (E5) e a esterol Δ8-Δ7-isomerase (E6). O último grupo metilo é retirado pola esterol desmetilase (E7) para formar episterol (12). O episterol (12) é metilado pola SAM para producir un segundo carbocatión, o cal perde un protón rendendo o 13. Este paso é catalizado pola 24-metilenesterol C-metiltransferase (E8). O composto 13 sofre agora unha redución polo NADPH e modificacións no anel β para formar β-sitosterol.
Notas
[editar | editar a fonte]- ↑ "Nutrition data: Foods highest in beta-sitosterol per 200 calorie serving". Conde Nast, USDA National Nutrient Database, version SR-21. 2014. Consultado o 25 de setembro de 2015.
- ↑ Wilt, T; Ishani, A; MacDonald, R; Stark, G; Mulrow, C; Lau, J (2000). "Beta-sitosterols for benign prostatic hyperplasia". The Cochrane Database of Systematic Reviews 2011 (2): CD001043. PMC 8407049. PMID 10796740. doi:10.1002/14651858.CD001043.
- ↑ Kim, T. H.; Lim, H. J.; Kim, M. S.; Lee, M. S. (2012). "Dietary supplements for benign prostatic hyperplasia: An overview of systematic reviews". Maturitas 73 (3): 180–5. PMID 22883375. doi:10.1016/j.maturitas.2012.07.007.
- ↑ Rudkowska I, AbuMweis SS, Nicolle C, Jones PJ (2008). "Cholesterol-lowering efficacy of plant sterols in low-fat yogurt consumed as a snack or with a meal". J Am Coll Nutr 27 (5): 588–95. PMID 18845709. doi:10.1080/07315724.2008.10719742.
- ↑ Patel Manoj D.; Thompson Paul D. (2006). "Phytosterols and Vascular Disease". Atherosclerosis 186 (1): 12–19. PMID 16325823. doi:10.1016/j.atherosclerosis.2005.10.026.
- ↑ G. Gallina; G. Ferretti; R. Merlanti; C. Civitareale; F. Capolongo; R. Draisci; C. Montesissa (2007). "Boldenone, Boldione, and Milk Replacers in the Diet of Veal Calves: The Effects of Phytosterol Content on the Urinary Excretion of Boldenone Metabolites". J. Agric. Food Chem. 55 (20): 8275–8283. PMID 17844992. doi:10.1021/jf071097c.
- ↑ Ros MM, Sterk SS, Verhagen H, Stalenhoef AF, de Jong N (2007). "Phytosterol consumption and the anabolic steroid boldenone in humans: a hypothesis piloted" (PDF). Food Addit. Contam. 24 (7): 679–84. PMID 17613052. doi:10.1080/02652030701216727.
- ↑ R. Draisci; R. Merlanti; G. Ferretti; L. Fantozzi; C. Ferranti; F. Capolongo; S. Segato; C. Montesissa (2007). "Excretion profile of boldenone in urine of veal calves fed two different milk replacers". Analytica Chimica Acta 586 (1–2): 171–176. PMID 17386709. doi:10.1016/j.aca.2007.01.026.
- ↑ Lenz, G. R.; Kirk-Othmer Encyclopedia of Chemical Technology, 3rd ed., Wiley Interscience, Londres, 1983, Vol. 21, 645.
- ↑ McCarthy, FO; Chopra, J; Ford, A; Hogan, SA; Kerry, JP; O'Brien, NM; Ryan, E; Maguire, AR (2005). "Synthesis, isolation and characterisation of beta-sitosterol and beta-sitosterol oxide derivatives". Organic & Biomolecular Chemistry 3 (16): 3059–65. PMID 16186940. doi:10.1039/b505069c.
- ↑ Hartmann, Marie-Andrée (2003). "5 Sterol metabolism and functions in higher plants". Lipid Metabolism and Membrane Biogenesis. Topics in Current Genetics 6. pp. 183–211. ISBN 978-3-540-20752-8. doi:10.1007/978-3-540-40999-1_6.
- ↑ De-Eknamkul W.; Potduang B. (2003). "Biosynthesis of β-Sitosterol and Stigmasterol in Croton sublyratus Proceeds Via a Mixed Origin of Isoprene Units". Phytochemistry 62 (3): 389–398. PMID 12620352. doi:10.1016/S0031-9422(02)00555-1.
- ↑ Dewick, P. M. Medicinal Natural Products: A Biosynthetic Approach. 3 ed.; John Wiley & Sons Ltd.: United Kingdom cyclization, 2009; p 539.