Glukosa
Glukosa, suatu gula monosakarida, adalah salah satu karbohidrat terpenting yang digunakan sebagai sumber tenaga bagi hewan dan tumbuhan. Glukosa merupakan salah satu hasil utama fotosintesis dan awal bagi respirasi. Bentuk alami (D-glukosa) disebut juga dekstrosa, terutama pada industri pangan.
 α-D-glukopiranosa (chair form)
| |
 Gambaran proyeksi Haworth struktur glukosa (α-D-glukopiranosa)
| |
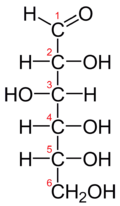
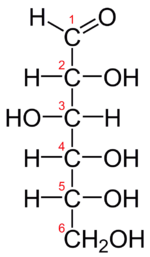 Proyeksi Fischer dari D-glukosa
| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
D-Glukosa | |
| Nama IUPAC (sistematis)
(2R,3S,4R,5R)-2,3,4,5,6-Pentahydroxyhexanal | |
| Nama lain
Gula darah
Dekstrosa Gula jagung D-Glukosa Gula anggur | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Singkatan | Glc |
| Referensi Beilstein | 1281604 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
| Referensi Gmelin | 83256 |
| KEGG | |
| MeSH | Glucose |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| |
| |
| Sifat | |
| C6H12O6 | |
| Massa molar | 180,16 g·mol−1 |
| Penampilan | Bubuk putih |
| Densitas | 1.54 g/cm3 |
| Titik lebur | α-D-glukosa: 146 °C β-D-glukosa: 150 °C (302 °F; 423 K) |
| 909 g/1 L (25 °C (77 °F)) | |
| Termokimia | |
| Kapasitas kalor (C) | 218.6 J K−1 mol−1[1] |
| Entropi molar standar (S |
209.2 J K−1 mol−1[1] |
| Entalpi pembentukan standar (ΔfH |
−1271 kJ/mol [2] |
| Entalpi pembakaran standar ΔcH |
−2805 kJ/mol |
| Bahaya | |
| Lembar data keselamatan | ICSC 0865 |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |


Glukosa (C6H12O6, berat molekul 180.18) adalah heksosa—monosakarida yang mengandung enam atom karbon. Glukosa merupakan aldehida (mengandung gugus -CHO). Lima karbon dan satu oksigennya membentuk cincin yang disebut "cincin piranosa", bentuk paling stabil untuk aldosa berkabon enam. Dalam cincin ini, tiap karbon terikat pada gugus samping hidroksil dan hidrogen kecuali atom kelimanya, yang terikat pada atom karbon keenam di luar cincin, membentuk suatu gugus CH2OH. Struktur cincin ini berada dalam kesetimbangan dengan bentuk yang lebih reaktif, yang proporsinya 0.0026% pada pH 7.
Glukosa merupakan sumber tenaga yang terdapat di mana-mana dalam biologi. Kita dapat menduga alasan mengapa glukosa, dan bukan monosakarida lain seperti fruktosa, begitu banyak digunakan. Glukosa dapat dibentuk dari formaldehida pada keadaan abiotik, sehingga akan mudah tersedia bagi sistem biokimia primitif. Hal yang lebih penting bagi organisme tingkat atas adalah kecenderungan glukosa, dibandingkan dengan gula heksosa lainnya, yang tidak mudah bereaksi secara nonspesifik dengan gugus amino suatu protein. Reaksi ini (glikosilasi) mereduksi atau bahkan merusak fungsi berbagai enzim. Rendahnya laju glikosilasi ini dikarenakan glukosa yang kebanyakan berada dalam isomer siklik yang kurang reaktif. Meski begitu, komplikasi akut seperti diabetes, kebutaan, gagal ginjal, dan kerusakan saraf periferal (‘’peripheral neuropathy’’), kemungkinan disebabkan oleh glikosilasi protein.
Dalam respirasi, melalui serangkaian reaksi terkatalisis enzim, glukosa teroksidasi hingga akhirnya membentuk karbon dioksida dan air, menghasilkan energi, terutama dalam bentuk ATP.[3] Sebelum digunakan, glukosa dipecah dari polisakarida.[4]
Glukosa dan fruktosa diikat secara kimiawi menjadi sukrosa. Pati, selulosa, dan glikogen merupakan polimer glukosa umum polisakarida).
Dekstrosa terbentuk akibat larutan D-glukosa berotasi terpolarisasi cahaya ke kanan. Dalam kasus yang sama D-fruktosa disebut "levulosa" karena larutan levulosa berotasi terpolarisasi cahaya ke kiri.
Isomerisme
suntingGula terdapat dalam dua enantiomer ( isomer cermin), D-glukosa dan L-glukosa, tetapi pada organisme, yang ditemukan hanya isomer D-isomer. Suatu karbohidrat berbentuk D atau L berkaitan dengan konformasi isomerik pada karbon 5. Jika berada di kanan proyeksi Fischer, maka bentuk cincinnya adalah enantiomer D, kalau ke kiri, maka menjadi enantiomer L. Sangat mudah diingat, merujuk pada D untuk "dextro”, yang merupakan akar bahasa Latin untuk "right" (kanan), sedangkan L untuk "levo" yang merupakan akar kata "left" (kiri). Struktur cincinnya sendiri dapat terbentuk melalui dua cara yang berbeda, yang menghasilkan glukosa-α (alfa) jeungt β (beta). Secara struktur, glukosa-α jeung -β berbeda pada gugus hidroksil yang terikat pada karbon pertama pada cincinnya. Bentuk α memiliki gugus hidroksil "di bawah" hidrogennya (sebagaimana molekul ini biasa digambarkan, seperti terlihat pada gambar di atas), sedangkan bentuk β gugus hidroksilnya berada "di atas" hidrogennya. Dua bentuk ini terbentuk bergantian sepanjang waktu dalam larutan air, hingga mencapai nisbah stabil α:β 36:64, dalam proses yang disebut mutarotasi yang dapat dipercepat.[5]
Sintesis
sunting- sebagai hasil fotosintesis pada tumbuhan dan beberapa prokariota.
- terbentuk dalam hati dan otot rangka dari pemecahan simpanan glikogen (polimer glukosa).
- disintesis dalam hati dan ginjal dari zat antara melalui proses yang disebut glukoneogenesis.
Peran dalam metabolisme
suntingKarbohidrat merupakan sumber energi utama bagi tubuh manusia, yang menyediakan 4 kalori (17 kilojoule) energi pangan per gram. Pemecahan karbohidrat (misalnya pati) menghasilkan mono- dan disakarida, terutama glukosa. Melalui glikolisis, glukosa segera terlibat dalam produksi ATP, pembawa energi sel. Di sisi lain, glukosa sangat penting dalam produksi protein dan juga dalam metabolisme lipid. Karena pada sistem saraf pusat tidak ada metabolisme lipid, jaringan ini sangat tergantung pada glukosa.
Glukosa diserap ke dalam peredaran darah melalui saluran pencernaan. Sebagian glukosa ini kemudian langsung menjadi bahan bakar sel otak, sedangkan yang lainnya menuju hati dan otot, yang menyimpannya sebagai glikogen ("pati hewan") dan sel lemak, yang menyimpannya sebagai lemak. Glikogen merupakan sumber energi cadangan yang akan dikonversi kembali menjadi glukosa pada saat dibutuhkan lebih banyak energi. Meskipun lemak simpanan dapat juga menjadi sumber energi cadangan, lemak tak pernah secara langsung dikonversi menjadi glukosa. Fruktosa dan galaktosa, gula lain yang dihasilkan dari pemecahan karbohidrat, langsung diangkut ke hati, yang mengkonversinya menjadi glukosa.
Lihat pula
suntingReferensi
sunting- ^ a b Boerio-Goates, Juliana (1991), "Heat-capacity measurements and thermodynamic functions of crystalline α-D-glucose at temperatures from 10K to 340K", J. Chem. Thermodynam., 23 (5): 403–9, doi:10.1016/S0021-9614(05)80128-4.
- ^ Ponomarev, V. V.; Migarskaya, L. B. (1960), "Heats of combustion of some amino-acids", Russ. J. Phys. Chem. (Engl. Transl.), 34: 1182–83.
- ^ Medical Biochemistry at a Glance @Google books, Blackwell Publishing, 2006, hlm. 52, ISBN 978-1-4051-1322-9, diarsipkan dari versi asli tanggal 2023-08-06, diakses tanggal 2015-01-22
- ^ Medical Biochemistry at a Glance @Google books, Blackwell Publishing, 2006, hlm. 50, ISBN 978-1-4051-1322-9, diarsipkan dari versi asli tanggal 2023-08-06, diakses tanggal 2015-01-22
- ^ Kirschner, Karl N.; Woods, Robert J. (2001), "Solvent interactions determine carbohydrate conformation", Proc. Natl. Acad. Sci. USA, 98 (19): 10541–45, doi:10.1073/pnas.191362798, PMC 58501 , PMID 11526221