Човечка митохондријална генетика

Човечка митохондријална генетика е проучување на генетиката на човечката митохондриска ДНК. Човечкиот митохондријален геном е целина со наследни информации што се содржат во човековите митохондрии. Митохондриите се мали структури во клетките кои генерираат енергија за клетката да ја користи, и затоа се нарекуваат „моќни куќи“ на клетката.
митохондриската ДНК (mtDNA) не се пренесува преку нуклеарна ДНК (nDNA). Кај луѓето, како и кај голем број повеќеклеточни организми, митохондриската ДНК се наследува само од јајце клетката на мајката. Сепак, постојат теории дека преносот на mtDNA од страна на таткото кај луѓето може да се случи под одредени околности.[3] Затоа, митохондријалното наследство е неменделско, бидејќи менделовото наследство претпоставува дека половина од генетскиот материјал на оплодената јајце клетка (зигот) потекнува од секој родител.
Осумдесет проценти од митохондриската ДНК кодови за митохондриска РНК, и затоа повеќето мутации на митохондриската ДНК доведувале до функционални проблеми, кои може да се манифестираат како мускулни нарушувања (миопатии).
Бидејќи тие обезбедуваат 30 молекули на АТП по молекула на гликоза, за разлика од 2-те АТП молекули произведени со гликолиза, митохондриите се неопходни за сите повисоки организми за одржување на животот. Митохондриските болести се генетски нарушувања кои се пренесуваат во митохондриската ДНК или нуклеарна ДНК која ги кодира митохондриските компоненти.
Квантитет
[уреди | уреди извор]Кај луѓето, митохондриската ДНК (mtDNA) формира затворени кружни молекули кои што содржат 16.569[4][5] базни парови на ДНК,[6] при што секоја таква молекула нормално содржи целосен сет на митохондриски гени. Секоја човечки митохондрија содржи, во просек, приближно 5 такви mtDNA молекули, со количина од 1 до 15.[6] Секоја човечка клетка содржи приближно 100 митохондрии, што дава вкупен број на mtDNA молекули по човечка клетка од приближно 500.[6] Количината на митохондриите по клетката, варира според типот на клетката, со некои примери:
- Еритроцити: 0 митохондрии по клетка.[1]
- Лимфоцити: 3 митохондрии по клетка.[7]
- Јајце-клетка: Зрелата метафаза II јајце клетки може да содржат 100.000 митохондрии и 50.000-1.500.000 копии од митохондриски от геном (што одговара на до 90% од ДНК на јајце клетката).[2]
Шаблони за наследување
[уреди | уреди извор]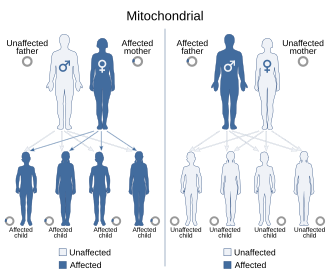

Бидејќи митохондриските болести (болести предизвикани од дефект на митохондриите) можат да се наследат и од мајката и преку хромозомското наследство, начинот на кој тие се пренесуваат од генерација на генерација може многу да варира во зависност од болеста. митохондриските генетски мутации што се наоѓаат во нуклеарната ДНК може да се појават во кој било од хромозомите (зависи од видот). Мутациите наследени од хромозомите можат да бидат автосомно доминантни или рецесивни, а исто така може да бидат доминантни или рецесивни поврзани со полот. Хромозомското наследување ги следи нормалните менделови закони, а фенотипот на болеста може да биде маскиран.
Поради сложените начини на комуникација меѓу митохондријалната и нуклеарната ДНК, дури и навидум едноставното наследство е тешко да се дијагностицира. Мутација во хромозомската ДНК може да промени протеин кој го регулира (го зголемува или намалува) производството на друг одреден протеин во митохондриите или цитоплазмата; ова може да доведе до благи и забележливи симптоми. Некои мутации на mtDNA лесно се дијагностицираат поради широко распространето оштетување на мускулните, нервните и/или хепаталните ткива и затоа што се присутни кај мајката и сите потомството.
Бројот на засегнатите mtDNA молекули може многу да се менува бидејќи
- митохондриите во оплодениот ооцит е она со што ќе треба да започне новиот живот (во однос на mtDNA),
- бројот на засегнатите митохондрии варира од клетка (во овој случај, оплодената ооцит) до клетка во зависност и од бројот што го наследил од нејзината матична клетка и од факторите на околината кои можат да ја фаворизираат мутантната или дивата митохондријална ДНК,
- бројот на mtDNA молекули во митохондриите варира од околу два до десет.
При раѓање на близнаци, едно бебе да добие повеќе од половина мутантни mtDNA молекули додека другото бебе само мал дел од мутантните mtDNA молекули во однос на дивиот тип (во зависност од тоа како близнаците се делат едни од други и како многу мутантни митохондрии се случуваат на секоја страна од поделбата). Во неколку случаи, некои митохондрии или митохондрии од клетката на спермата влегуваат во ооцитот, но татковските митохондрии активно се распаѓаат.
Гени
[уреди | уреди извор]Гените во човечкиот митохондријален геном се како што следува.
Транспортен синџир на електрони и хуманин
[уреди | уреди извор]Најпрво имало погрешни верувања дека митохондрискиот геном содржи само 13 гени за кодирање на протеини, а сите ги кодираат протеините од транспортниот синџир на електрони. Меѓутоа, во 2001 година, бил откриен 14-ти биолошки активен протеин наречен хуманин и било откриено дека е кодиран од митохондриски от ген MT-RNR2, кој исто така кодира дел од митохондрискиот рибозом:
| Комплексен број |
Категорија | Гените | Позиции во митогеномот | Стренд |
|---|---|---|---|---|
| Јас | NADH дехидрогеназа | |||
| MT-ND1 | 3,307-4,262 | Л | ||
| MT-ND2 | 4.470-5.511 | Л | ||
| MT-ND3 | 10.059-10.404 | Л | ||
| MT-ND4L | 10.470-10.766 | Л | ||
| MT-ND4 | 10.760-12.137 (преклопување со MT-ND4L) | Л | ||
| MT-ND5 | 12.337-14.148 | Л | ||
| MT-ND6 | 14.149-14.673 | Х | ||
| III | Коензим Q - цитохром ц редуктаза / Цитохром б | MT-CYB | 14.747-15.887 | Л |
| IV | Цитохром c оксидаза | MT-CO1 | 5.904-7.445 | Л |
| MT-CO2 | 7.586-8.269 | Л | ||
| MT-CO3 | 9,207-9,990 | Л | ||
| В | АТП синтаза | MT-ATP6 | 8.527-9.207 (преклопување со MT-ATP8) | Л |
| MT-ATP8 | 8.366-8.572 | Л | ||
| - | Хуманин | MT-RNR2 | - | - |
За разлика од другите протеини, хуманинот не останува во митохондриите и е во интеракција со остатокот од клетката и клеточните рецептори. Хуманинот може да ги заштити мозочните клетки со инхибиција на апоптозата. Верзии на хуманин постојат и кај други животни, како што е ратин кај стаорци.
рРНК
[уреди | уреди извор]Следниве гени кодираат Рибозомна РНК:
| Подединица | rRNA | Гените | Позиции во митогеномот | Стренд |
|---|---|---|---|---|
| Мали (SSU) | 12S | MT-RNR1 | 648–1601 | Л |
| Голем (LSU) | 16S | MT-RNR2 | 1.671-3.229 | Л |
рРНК
[уреди | уреди извор]Следниве гени ги кодираат Транспортна РНК:
| Amino Acid | 3-Letter | 1-Letter | MT DNA | Positions | Strand |
|---|---|---|---|---|---|
| Аланин | Ala | A | MT-TA | 5,587–5,655 | H |
| Арганин | Arg | R | MT-TR | 10,405–10,469 | L |
| Аспарагин | Asn | N | MT-TN | 5,657–5,729 | H |
| Аспарагинска киселина | Asp | D | MT-TD | 7,518–7,585 | L |
| Цистеин | Cys | C | MT-TC | 5,761–5,826 | H |
| Глутаминска киселина | Glu | E | MT-TE | 14,674–14,742 | H |
| Глутамин | Gln | Q | MT-TQ | 4,329–4,400 | H |
| Глицин | Gly | G | MT-TG | 9,991–10,058 | L |
| Хистидин | His | H | MT-TH | 12,138–12,206 | L |
| Изолеуцин | Ile | I | MT-TI | 4,263–4,331 | L |
| Леуцин | Leu (UUR) | L | MT-TL1 | 3,230–3,304 | L |
| Леуцин | Leu (CUN) | L | MT-TL2 | 12,266–12,336 | L |
| Лизин | Lys | K | MT-TK | 8,295–8,364 | L |
| Метионин | Met | M | MT-TM | 4,402–4,469 | L |
| Фенеланин | Phe | F | MT-TF | 577–647 | L |
| Пролин | Pro | P | MT-TP | 15,956–16,023 | H |
| Серин | Ser (UCN) | S | MT-TS1 | 7,446–7,514 | H |
| Серин | Ser (AGY) | S | MT-TS2 | 12,207–12,265 | L |
| Треонин | Thr | T | MT-TT | 15,888–15,953 | L |
| Триптофан | Trp | W | MT-TW | 5,512–5,579 | L |
| Тирозин | Tyr | Y | MT-TY | 5,826–5,891 | H |
| Валин | Val | V | MT-TV | 1,602–1,670 | L |
Локација на гените
[уреди | уреди извор]Митохондриската ДНК имала две нишки на ДНК означени како тешка и лесна, поради нивните пловни густини за време на одвојувањето во градиентите на цезиум хлорид,[8][9] било откриено дека е поврзано со релативната содржина на нуклеотиди G+T на праменот.[10] Сепак, конфузијата на етикетирањето на оваа нишка е широко распространета и се чини дека потекнува од идентификацијата на мнозинската кодирана нишка како тешка во една влијателна статија во 1999 година.[10][11] Кај луѓето, лесната нишка на mtDNA носи 28 гени, а тешката нишка на mtDNA носи само 9 гени.[10][12] Осум од 9-те гени на тешката нишка кодираат за митохондриски tRNA молекули. Човечката mtDNA се состои од 16.569 нуклеотидни парови. Целата молекула е регулирана со еден регулаторен регион кој го содржел потеклото на репликацијата на тешките и лесните нишки. Целата човечка митохондриска молекула на ДНК била мапирана.
Варијанти на генетски код
[уреди | уреди извор]Генетскиот код е, во најголем дел, универзален, со неколку исклучоци:[13] митохондријалната генетика вклучува некои од нив. За повеќето организми „стоп-кодоните“ се „UAA“, „UAG“ и „UGA“. Во митохондриите на 'рбетниците „АГА“ и „АГГ“ се исто така стоп-кодони, но не и „УГА“, што наместо тоа шифрира за триптофан. „AUA“ шифрира за изолеуцин во повеќето организми, но за метионин во митохондријалната mRNA на 'рбетниците.
Овде се многу други варијации за шифрите што ги користат другите митохондриски m/tRNA, кои не се штетни за нивните организми и кои може да се користат како алатка (заедно со други мутации меѓу mtDNA/RNA од различни видови) за да се утврди релативна близина на заедничко потекло на сродни видови. (Колку повеќе се поврзани два вида, толку повеќе мутации на mtDNA/RNA ќе се исти во нивниот митохондријален геном).
Се проценува дека првите митохондрии се појавиле пред околу 1,5 милијарди години. Прифатена хипотеза е дека митохондриите настанале како аеробен прокариот во симбиоза со анаеробниот еукариот.
Репликација, поправка, транскрипција и превод
[уреди | уреди извор]Митохондријалната репликација е контролирана од нуклеарни гени и е специјално прилагодена за создавањето доволно митохондрии колку што ѝ требаат на одредена клетка во тоа време.
Митохондријалната транскрипција кај луѓето е иницирана од три промотори, H1, H2 и L. Промоторот H2 ја транскрибира речиси целата тешка жичка, а L промоторот ја транскрибира целата лесна нишка. Промоторот H1 предизвикува транскрипција на двете митохондриски rRNA молекули.[14]
Кога транскрипцијата се одвива на тешката нишка се создава полицистронски препис. Лесната нишка произведува или мали транскрипти, кои може да се користат како зачетници, или еден долг препис. Производството на прајмери се случува со обработка на транскрипти на лесни жици со митохондријална RNase MRP (Митохондријална RNA Processing). Барањето за транскрипција за производство на прајмери го поврзува процесот на транскрипција со репликацијата на mtDNA. Транскриптите со целосна должина се сечат на функционални tRNA, rRNA и mRNA молекули.
Процесот на започнување на транскрипција во митохондриите вклучува три типа на протеини: митохондријална РНК полимераза (POLRMT), митохондријален транскрипциски фактор А (TFAM) и митохондриски транскрипциски фактори B1 и B2 (TFB1M, TFB2M). POLRMT, TFAM и TFB1M или TFB2M се собираат кај митохондриските промотори и започнуваат со транскрипција. Вистинските молекуларни настани кои се вклучени во иницијацијата се непознати, но овие фактори ја формираат основната машина за транскрипција и се покажа дека функционираат ин витро.
Митохондрискиот превод сè уште не е многу добро разбран. Ин витро преводите сè уште не се успешни, веројатно поради тешкотијата да се изолира доволно mt mRNA, функционална mt rRNA, а можеби и поради комплицираните промени што ги претрпела mRNA пред да биде преведена.
Митохондриската ДНК полимераза
[уреди | уреди извор]Митохондриската ДНК полимераза (Pol гама, кодирана од генот POLG) се користи за копирање на mtDNA за време на репликацијата. Бидејќи двете (тешки и лесни) нишки на кружната mtDNA молекула имаат различно потекло на репликација, таа се реплицира во режим на Д-јамка. Едното влакно почнува да се реплицира прво, поместувајќи го другото влакно. Ова продолжува додека репликацијата не го достигне почетокот на репликацијата на другата жичка, во тој момент другата нишка почнува да се реплицира во спротивна насока. Ова резултира со две нови mtDNA молекули. Секоја митохондрија има неколку копии од молекулата mtDNA и бројот на mtDNA молекули е ограничувачки фактор во митохондријалната фисија. Откако митохондријата има доволно mtDNA, мембранска област и мембрански протеини, може да претрпи фисија (многу слична на онаа што ја користат бактериите) за да стане две митохондрии. Доказите сугерираат дека митохондриите, исто така, можат да претрпат фузија и размена (во форма на вкрстување) генетски материјал меѓу себе.
Оштетување и грешка при транскрипцијата
[уреди | уреди извор]митохондриската ДНК е подложна на оштетување од слободните кислородни радикали од грешките што се случуваат при производството на АТП преку синџирот на транспорт на електрони. Овие грешки можат да бидат предизвикани од генетски нарушувања, рак и температурни варијации. Овие радикали можат да ги оштетат молекулите на mtDNA или да ги променат, што го отежнува нивното реплицирање на митохондријалната полимераза. И двата случаи може да доведат до бришења, преуредувања и други мутации. Неодамнешните докази сугерирале дека митохондриите имале ензими кои ја коригираат mtDNA и ги поправаат мутациите што може да настанат поради слободните радикали. Се верувало дека ДНК рекомбиназа пронајдена во клетките на цицачите е исто така вклучена во процесот на поправка на рекомбинација. Бришењето и мутациите поради слободните радикали се поврзани со процесот на стареење. Се верувало дека радикалите предизвикуваат мутации што доведуваат до мутантни протеини, што пак довело до повеќе радикали. Овој процес траел многу години и е поврзан со процеси на стареење вклучени во ткивата зависни од кислород како што се мозокот, срцето, мускулите и бубрезите. Автоматските процеси како што се овие се можни причини за дегенеративни болести, вклучувајќи Паркинсонова, Алцхајмерова и коронарна артериска болест.
Хромозомски посредувани грешки во репликацијата на mtDNA
[уреди | уреди извор]Бидејќи митохондријалното растење и фисија се посредувани од нуклеарната ДНК, мутациите во нуклеарната ДНК можат да имаат многу ефекти врз репликацијата на mtDNA. И покрај тоа што локусите за некои од мутациите се пронајдени на човечките хромозоми, специфичните гени и протеини кои се вклучени сè уште не се изолирани. На митохондриите им треба одреден протеин за да се подложат на фисија. Ако овој протеин (генериран од јадрото) не е присутен, митохондриите растат, но тие не се делат. Ова води до џиновски, неефикасни митохондрии. Грешките во хромозомските гени или нивните производи, исто така, може да влијаат подиректно на митохондријалната репликација со инхибиција на митохондријалната полимераза и дури може да предизвикаат мутации во mtDNA директно и индиректно. Индиректните мутации се формирани најчесто од неисправни протеини направени од нуклеарна ДНК.
Митохондриски заболувања
[уреди | уреди извор]Придонес на митохондрискиот наспроти нуклеарниот геном
[уреди | уреди извор]Митохондријата е домаќин на околу 3000 различни видови на протеини, но само околу 13 од нив се кодирани на митохондриската ДНК. Повеќето од 3000 видови на протеини се вклучени во различни процеси освен производството на АТП, како што е синтезата на порфирин. Само 3% од нив кодираат протеини за производство на АТП. Ова значи дека поголемиот дел од генетските информации кои го кодираат протеинскиот состав на митохондриите се во хромозомската ДНК и се вклучени во процеси различни од синтезата на АТП. Ова ги зголемува шансите дека мутација што ќе влијае на митохондрија ќе се појави во хромозомската ДНК, која е наследена по менделова шема. Другиот резултат е дека хромозомската мутација ќе влијае на одредено ткиво поради неговите специфични потреби, без разлика дали тоа може да се високи енергетски потреби или потреба за катаболизам или анаболизам на специфичен невротрансмитер или нуклеинска киселина.
Презентација
[уреди | уреди извор]Митохондриските болести се движат по сериозност од асимптоматски до фатални и најчесто се должат на наследни, а не на стекнати мутации на митохондриската ДНК. Дадена митохондријална мутација може да предизвика разни болести во зависност од сериозноста на проблемот во митохондриите и ткивото во кое се зафатените митохондрии. Спротивно на тоа, неколку различни мутации може да се претстават како иста болест. Оваа речиси специфична карактеризација на митохондриските болести за пациентот (види Персонализирана медицина) го прави многу тешко прецизно да се препознаат, дијагностицираат и следат. Некои болести се забележливи на или дури и пред раѓањето (многу од нив предизвикуваат смрт), додека други не се манифестираат до доцна зрелост (нарушувања со доцен почеток). Тоа е затоа што бројот на мутантни наспроти диви митохондрии варира помеѓу клетките и ткивата и постојано се менува. Бидејќи клетките имаат повеќе митохондрии, различни митохондрии во иста клетка може да имаат различни варијации на mtDNA. Оваа состојба се нарекува хетероплазмија. Кога некое ткиво ќе достигне одреден сооднос на мутантни наспроти диви митохондрии, ќе се појави болест. Односот варирал од личност до личност и од ткиво до ткиво (во зависност од неговите специфични потреби за енергија, кислород и метаболизам и ефектите на специфичната мутација). Митохондриските болести се многубројни и различни. Освен болестите предизвикани од абнормалности во митохондриската ДНК, многу болести се сомневаат дека делумно се поврзани со митохондриски дисфункции, како што се дијабетес мелитус,[15] форми на рак[16] и кардиоваскуларни болести, млечна ацидоза,[17] специфични форми на миопатија,[18] остеопороза,[19] Алцхајмерова болест,[20] Паркинсонова болест,[21] мозочен удар,[22] машка неплодност[23] и за кои исто така се верува дека играат улога во процесот на стареење.[24]
Употреба во форензиката
[уреди | уреди извор]Човечката mtDNA може да се користи и за да помогне во идентификувањето на поединци.[25] Форензичките лаборатории повремено користат споредба на mtDNA за да идентификуваат човечки остатоци, а особено за да идентификуваат постари неидентификувани скелетни остатоци. Иако за разлика од нуклеарната ДНК, mtDNA не е специфична за една индивидуа, таа може да се користи во комбинација со други докази (антрополошки докази, посредни докази и слично) за да се утврди идентификација. mtDNA исто така се користи за да се исклучат можните совпаѓања меѓу исчезнатите лица и неидентификуваните остатоци.[26] Многу истражувачи веруваат дека mtDNA е подобра во идентификација на постари скелетни остатоци од нуклеарна ДНК, бидејќи поголемиот број на копии на mtDNA по клетка ја зголемува можноста за добивање корисен примерок, и затоа што е можно совпаѓање со жив роднина дури и ако има бројни мајчини генерации ги раздвојуваат двете.
Примери
[уреди | уреди извор]Слично на тоа, посмртните остатоци на Александра Фјодоровна (Аликс од Хесен), последната царица на Русија, и нејзините деца биле идентификувани со споредба на нивната митохондријална ДНК со онаа на принцот Филип, војводата од Единбург, чија баба по мајка била сестрата на Александра, Викторија од Хесен.[27]
Слично, за да се идентификува митохондриска ДНК на императорот Николај II била споредувана со митохондриската ДНК на Џејмс Карнеги, третиот војвода од Фајф, чија прабаба по мајка Александра од Данска (Кралица Александра) била сестра на Николај II, мајката Дагмар од Данска (царица Марија Федоровна).[27][28]
На сличен начин биле идентификувани остатоците на кралот Ричард III.
Поврзано
[уреди | уреди извор]- Пренос на mtDNA од татко
- Човечка митохондријална ДНК хаплогрупи
- Референтна секвенца на Кембриџ
- Човечки митохондријален молекуларен часовник
- Генетска генеалогија за списоци на бази на податоци кои им помагаат на корисниците да најдат други со нивната Y-DNA и mtDNA.
Наводи
[уреди | уреди извор]- ↑ 1,0 1,1 Shuster RC, Rubenstein AJ, Wallace DC (1988). „Mitochondrial DNA in anucleate human blood cells“. Biochem Biophys Res Commun. 155 (3): 1360–5. doi:10.1016/s0006-291x(88)81291-9. PMID 3178814.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ 2,0 2,1 Zhang D, Keilty D, Zhang ZF, Chian RC (2017). „Mitochondria in oocyte aging: current understanding“. Facts Views Vis Obgyn. 9 (1): 29–38. PMC 5506767. PMID 28721182.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Schwartz, Marianne; Vissing, John (22 August 2002). „Paternal Inheritance of Mitochondrial DNA“. New England Journal of Medicine. 347 (8): 576–580. doi:10.1056/NEJMoa020350. PMID 12192017.
- ↑ Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R.; Drouin, J.; Eperon, I. C.; Nierlich, D. P.; Roe, B. A. (April 1981). „Sequence and organization of the human mitochondrial genome“. Nature. 290 (5806): 457–465. Bibcode:1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534.
- ↑ „Untitled“. Архивирано од изворникот на 2011-08-13. Посетено на 2012-06-13.
- ↑ 6,0 6,1 6,2 Satoh, M; Kuroiwa, T (September 1991). „Organization of multiple nucleoids and DNA molecules in mitochondria of a human cell“. Experimental Cell Research. 196 (1): 137–140. doi:10.1016/0014-4827(91)90467-9. PMID 1715276.
- ↑ Nagy G, Barcza M, Gonchoroff N, Phillips PE, Perl A (2004). „Nitric oxide-dependent mitochondrial biogenesis generates Ca2+ signaling profile of lupus T cells“. J Immunol. 173 (6): 3676–83. doi:10.4049/jimmunol.173.6.3676. PMC 4034140. PMID 15356113.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Zimmerman, Earl G.; Akins, Darrin R.; Planz, John V.; Schurr, Michael J. (September 1988). „A rapid procedure for isolating mitochondrial DNA“. Gene Analysis Techniques. 5 (5): 102–104. doi:10.1016/0735-0651(88)90004-0. PMID 2847966.
- ↑ Welter, Cornelius; Meese, Eckart; Blin, Nikolaus (1988). „Rapid step-gradient purification of mitochondrial DNA“. Molecular Biology Reports. 13 (2): 117–120. doi:10.1007/BF00539059. PMID 3221842.
- ↑ 10,0 10,1 10,2 Barroso Lima, Nicholas Costa; Prosdocimi, Francisco (17 February 2018). „The heavy strand dilemma of vertebrate mitochondria on genome sequencing age: number of encoded genes or G + T content?“. Mitochondrial DNA Part A. 29 (2): 300–302. doi:10.1080/24701394.2016.1275603. PMID 28129726.
- ↑ Taanman, Jan-Willem (February 1999). „The mitochondrial genome: structure, transcription, translation and replication“. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1410 (2): 103–123. doi:10.1016/s0005-2728(98)00161-3. PMID 10076021.
- ↑ Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R.; Drouin, J.; Eperon, I. C.; Nierlich, D. P.; Roe, B. A. (1981). „Sequence and organization of the human mitochondrial genome“. Nature. 290 (5806): 457–65. Bibcode:1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534.
- ↑ „The Genetic Codes“. www.ncbi.nlm.nih.gov. National Center for Biotechnology Information. Посетено на 16 March 2019.
- ↑ Asin-Cayuela, Jordi; Gustafsson, Claes M. (2007). „Mitochondrial transcription and its regulation in mammalian cells“. Trends in Biochemical Sciences. 32 (3): 111–17. doi:10.1016/j.tibs.2007.01.003. PMID 17291767.
- ↑ Tanaka, Masashi; Fuku, Noriyuki; Nishigaki, Yutaka; Matsuo, Hitoshi; Segawa, Tomonori; Watanabe, Sachiro; Kato, Kimihiko; Yoko, Kiyoshi; Ito, Masafumi (February 2007). „Women With Mitochondrial Haplogroup N9a Are Protected Against Metabolic Syndrome“. Diabetes. 56 (2): 518–521. doi:10.2337/db06-1105. PMID 17259400.
- ↑ Theodoratou, Evropi; Din, Farhat V.N.; Farrington, Susan M.; Cetnarskyj, Roseanne; Barnetson, Rebecca A.; Porteous, Mary E.; Dunlop, Malcolm G.; Campbell, Harry; Tenesa, Albert (February 2010). „Association between common mtDNA variants and all-cause or colorectal cancer mortality“. Carcinogenesis. 31 (2): 296–301. doi:10.1093/carcin/bgp237. PMID 19945968.
- ↑ Goto, Y (September 1993). „[MELAS (mitochondrial myopathy, encephalopathy lactic acidosis, and stroke-like episodes): clinical features and mitochondrial DNA mutations]“. Nihon Rinsho. Japanese Journal of Clinical Medicine. 51 (9): 2373–8. PMID 8411715.
- ↑ Ahuja, Abhimanyu S. (21 May 2018). „Understanding mitochondrial myopathies: a review“. PeerJ. 6: e4790. doi:10.7717/peerj.4790. PMC 5967365. PMID 29844960.
- ↑ Angireddy, Rajesh; Kazmi, Hasan Raza; Srinivasan, Satish; Sun, Li; Iqbal, Jameel; Fuchs, Serge Y.; Guha, Manti; Kijima, Takashi; Yuen, Tony (August 2019). „Cytochrome c oxidase dysfunction enhances phagocytic function and osteoclast formation in macrophages“. The FASEB Journal. 33 (8): 9167–9181. doi:10.1096/fj.201900010RR. PMC 6662975. PMID 31063702.
- ↑ Carrieri, Giuseppina; Bonafè, Massimiliano; De Luca, Maria; Rose, Giuseppina; Varcasia, Ottavia; Bruni, Amalia; Maletta, Raffaele; Nacmias, Benedetta; Sorbi, Sandro (March 2001). „Mitochondrial DNA haplogroups and APOE4 allele are non-independent variables in sporadic Alzheimer's disease“. Human Genetics. 108 (3): 194–198. doi:10.1007/s004390100463. PMID 11354629.
- ↑ Martín-Jiménez, Rebeca; Lurette, Olivier; Hebert-Chatelain, Etienne (1 August 2020). „Damage in Mitochondrial DNA Associated with Parkinson's Disease“. DNA and Cell Biology. 39 (8): 1421–1430. doi:10.1089/dna.2020.5398. PMID 32397749.
- ↑ Chinnery, Patrick F; Elliott, Hannah R; Syed, Anila; Rothwell, Peter M (May 2010). „Mitochondrial DNA haplogroups and risk of transient ischaemic attack and ischaemic stroke: a genetic association study“. The Lancet Neurology. 9 (5): 498–503. doi:10.1016/S1474-4422(10)70083-1. PMC 2855429. PMID 20362514.
- ↑ Ruiz-Pesini, Eduardo; Lapeña, Ana-Cristina; Díez-Sánchez, Carmen; Pérez-Martos, Acisclo; Montoya, Julio; Alvarez, Enrique; Díaz, Miguel; Urriés, Antonio; Montoro, Luis (September 2000). „Human mtDNA Haplogroups Associated with High or Reduced Spermatozoa Motility“. The American Journal of Human Genetics. 67 (3): 682–696. doi:10.1086/303040. PMC 1287528. PMID 10936107.
- ↑ Courtenay, Monique D.; Gilbert, John R.; Jiang, Lan; Cummings, Anna C.; Gallins, Paul J.; Caywood, Laura; Reinhart-Mercer, Lori; Fuzzell, Denise; Knebusch, Claire (February 2012). „Mitochondrial Haplogroup X is associated with successful aging in the Amish“. Human Genetics. 131 (2): 201–208. doi:10.1007/s00439-011-1060-3. PMC 4834861. PMID 21750925.
- ↑ Brown, W. M. (1 June 1980). „Polymorphism in mitochondrial DNA of humans as revealed by restriction endonuclease analysis“. Proceedings of the National Academy of Sciences. 77 (6): 3605–3609. Bibcode:1980PNAS...77.3605B. doi:10.1073/pnas.77.6.3605. PMC 349666. PMID 6251473.
- ↑ „Paleo-DNA Laboratory – Forensic Services“. Архивирано од изворникот на 2012-03-13. Посетено на 2012-06-13.
- ↑ 27,0 27,1 Gill, Peter; Ivanov, Pavel L.; Kimpton, Colin; Piercy, Romelle; Benson, Nicola; Tully, Gillian; Evett, Ian; Hagelberg, Erika; Sullivan, Kevin (February 1994). „Identification of the remains of the Romanov family by DNA analysis“. Nature Genetics. 6 (2): 130–135. doi:10.1038/ng0294-130. PMID 8162066.
- ↑ Ivanov, Pavel L.; Wadhams, Mark J.; Roby, Rhonda K.; Holland, Mitchell M.; Weedn, Victor W.; Parsons, Thomas J. (April 1996). „Mitochondrial DNA sequence heteroplasmy in the Grand Duke of Russia Georgij Romanov establishes the authenticity of the remains of Tsar Nicholas II“. Nature Genetics. 12 (4): 417–420. doi:10.1038/ng0496-417. PMID 8630496.
Надворешни врски
[уреди | уреди извор]- National Institutes of Health. „Mitochondrial DNA“. Genetics Home Reference. Посетено на 2017-05-06.
- ^ „Societat Catalana de Neurologia“. Архивирано од изворникот на November 18, 2005. Посетено на December 5, 2005.
- ^ „MITOMAP Genome“ (PDF). Архивирано од изворникот (PDF) на April 8, 2005. Посетено на December 5, 2005.