Wikipedysta:Mpn/brudnopis/B029

Cykl miesiączkowy, cykl menstruacyjny – cykl naturalnych zmian zachodzących w macicy i jajnikach pełniący kluczową rolę w zapewnieniu płodności[1][2]. Czas, w którym zachodzi, podlega regulacji innych endogennych cykli biologicznych. Jest nieodzowny dla produkcji komórek jajowych i przygotowania macicy do ciąży[1]. Zachodzi jedynie u płodnych samic naczelnych, w tym u kobiet, u których powtarza się on od pierwszej miesiączki (menarche) aż do ostatniej (menopauza), kiedy ulega zakończeniu.
U ludzi długość cyklu miesiączkowego różni się znacznie. Trwa on od 21 do 35 dni, średnio 28 dni[3]. Każdy taki cykl podzielić można na 3 fazy bądź na cykle dotyczące jajników i macicy[1]. Cykl jajnikowy składa się z fazy folikularnej, owulacji i fazy lutealnej. podczas gdy cykl maciczny dzieli się na menstruację, fazę proliferacyjną i wydzielniczą. Oba te cykle kontroluje układ wewnątrzwydzielniczy. Na naturalnie zachodzące zmiany hormonale wpływa antykoncepcja hormonalna, stosowana w celu uniknięcia reprodukcji[4].
Zgodnie z konwencją długość indywidualnego cyklu miesiączkowego liczy się w dniach począwszy od pierwszego dnia krwawienia miesięcznego. Stopniowo wzrastające w fazie folikularnej stężenie estrogenów powoduje stymulację, krwawienie zmnijesza się i zatrzymuje, a endometrium ulega pogrubieniu. Pęcherzyki w jajnikach zaczynają rozwijać się pos wpływem złożonej gry hormonów. Po pewnym czasie jedn, a okazjonalnie dwa stają się dominujące, podczas gdy reszta ulega atrofii, by umrzeć. Mniej więcej w połowie cyklu, od 24 do 36 godzin po piku lutropiny, dominujący pęcherzyk uwalnia komórkę jajową w procesie zwanym owulacją. Po opuszczeniu pęcherzyka jajo żyje tylko 24 godziny bądź jeszcze mniej, jesli nie ulegnie zapłodnieniu, podczas gdy pozostałości dominującego pęcherzyka tworzą ciałko żółte, przejmujące na siebie główną rolę w produkcji progesteronu. Pod wpływem tego hormonu endometrium zmienia się, by przygotować się do potencjalnej implantacja|implantacji zarodka, co rozpoczyna ciążę. Jeśli do implantacji nie dojdzie w czasie około dwóch tygodni, ciałko żółte ulegnie inwolucji, powodując gwałtowne spadki w stężeniach hormonów: estrogenów i progesteronu. Powoduje to złuszczenie się zewnętrznej wartswy wyściółki macicy i usunięcie jej wraz z jajem w procesie zwanym menstruacją.
W obrębie cyklu miesiączkowego zmiany zachodzą nie tylko w żeńskim układzie rozrodczym, aale także w innych układach ciała. Może to skutkować między innymi bolesnością sutków czy zmianami nastroju. Pierwsza miesiączka w życiu kobiety, określana mianem menarche, pojawia się około wieku 12-13 lat. Koniec okresu płodności, czyli menopauza, przypada na okres pomiędzy 45 a 55 lat.
Średni wiek ludzkiej menarche to 12–13 lat, jednak za normę uważa się wystąpienie pierwszej miesiączki pomiędzy wiekiem 8 i 16 lat. W Stanach Zjednoczonych średnia wynosi 12,5[5], 12,72 w Kanadzie[6] i 12,9 w Wielkiej Brytanii[7] i 13,06 ± 0,10 lat w Islandii[8]. Na przyśpieszenie lub opóźnienie menarche wpływają czyniki dziedziczne, dieta i ogólna kondycja zdrowotna[9]. W okresie okołomenopauzalnym kobieta zaprzestaje miesiączkować, kończąc swój okres zdolności do rozrodu. Średni czas menopauzy to u kobiet 52 lata, najczęściej przypada ona na zakres 45-55 lat. menopauzę przed wiekiem 45 lat określa się w krajach uprzemysłowionych jako przedwczesną[10]. Jak w przypadku menarche, czas menopauzy stanowi w dużym stopniu rezultat uwarunkowań kulturowych i biologicznych[11], jednakże choroby, pewne rodzaje operacji chirurgicznych czy inne typy terapii mogą powodować wcześniejsze wystąpienie menopauzy[12].
Długość cyklu miesiączkowego kobiety może zawyczaj ulegać nieznacznym zmianom, niektóre cykle są dłuższe, inne krótsze. Jeśli różnica pomiędzy najdłuższym i najkrótszym cyklem danej kobiety wynosi mniej od 8 dni, uznaje się, że miesiączkuje ona regularnie. Rzadko się zdarza, by kobieta odczuwała zmiany cykle mnijesze, niż 4 dni. Natomiast zmienność pomiędzy 8 a 20 dni oznacza umiarkowanie nieregularny cykl miesiączkowy. Zmienność od 21 dni oznacza, że kobieta miesiączkuje bardzo nieregularnie[13].
W licznych krajach, głównie w Azji, legislacja bądź korporacje wprowadziły formalne prawo pozwalające kobiecie na płatną bądź bezpłataną nieobecność w pracy podczas menstruacji (menstrual leave)[14][15]. Praktyka ta budzi kontrowersje[16][17].
Cykle i fazy
[edytuj | edytuj kod]
Cykl miesiączkowy opisać można jako cykl jajnikowy i maciczny. Cykl jajnikowy obejmuje zmiany zachodzące w pęcherzykach jajnikowych, podczas gdy cykl maciczny polega na zmianach wyściółki macicy. Każdy z nich można podzielić na 3 fazy. Cykl jajnikowy składa się z fazy folikularnej, owulacji i fazy lutealnej, podczas gdy cykl maciczny obejmuję menstruację, fazę proliferacyjną i sekrecyjną[1].
Cykl jajnikowy
[edytuj | edytuj kod]Faza folikularna
[edytuj | edytuj kod]Faza folikularna stanowi pierwszy etap cyklu jajnikowego. W jej trakcie pęcherzyk jajnikowy dojrzewa i osiąga zdolność do uwolnienia komórki jajowej[1]. Późniejsza część tej fazy pokrywa się z fazą proliferacyjną cyklu zmian macicy.
Poprzez wpływ wzrastających stężeń hormonu folikulotropowego (FSH – follicle stimulating hormone) w pierwszych dniach cyklu kilka pęcherzyków jajnikowych ulega stymulacji[18]. Pęcherzyki te obecne są już przy narodzinach[18] i rozwijają się przez większą część roku w procesie zwanym folikulogenezą, konkurując ze sobą aż do osiągnięcia dominacji. Pod wpływem licznych hormonów wszystkie prócz dominującego zatrzymują swój wzrost. Dominujący pęcherzyk kontynuuje rozwój, by osiągnąć dojrzałość. Gdy dojrzeje, staje się pęcherzykiem trzeciorzędowym, czyli pęcherzykiem Graafa[18].
Owulacja
[edytuj | edytuj kod]
Owulacja stanowi drugi etap w cyklu jajnikowym. Polega na uwolnienia dojrzałej komórki jajowej z pęcherzyka jajnikowego. Trafia ona do jajowodu[19]. Podczas fazy polikularnej estradiol hamował produkcję lutropiny przez przednią część przysadki. Gdy jajo jest już prawie dojrzałe, poziom estradiolu osiąga wartość progową, przy której jego wpływ na LH ulega odwróceniu – estrogen zaczyna stymulować syntezę znacznych ilości hormonu luteinizującego. Obserwuje się pik LH, który zaczyna się około 112 dnia cyklu i trwa przez 48 godzin[20].
Dokładny mechanizm tych dwóch przeciwstawnych odpowiedzi LH na poziom estradiolu nie został jeszcze dokładnie wyjasniony[21]:86. U niektórych zwierząt wykazano pik gonadoliberyny (GnRH) poprzedzający pik lutropiny, co sugeruje, że estrogen wpływają głównie na podwzgórze, kontrolujące sekrecję[21]:86. Być może zapewniały to 2 rodzaje receptorów estrogenowych w podwzgórzu. Receptor estrogenowy α odpowiada za sprzężęnie zwrotne ujemne, podczas gdy receptor estrogenowy β zapewnia sprzężenie zwrotne dodatnie pomiędzy LH i estradiolem[22]. Jednakże u człowieka wykazano, że wysokie stężenia estradiolu mogą prowokować nagłe wzrosty stężenia LH, nawet w przypadku stałych stężeń i częstości pulsów gonadoliberyny[21]:86. Wskazuje to, że u ludzi estrogen działa bezpośrednio na przysadkę, stymulując pik LH.
Sekrecja LH powoduje dojrzewanie jaja i osłabia ścianę pęcherzyka jajnikowego. Powoduje to uwolnienie oocytu II rzędu przez w pełni rozwinięty pęcherzyk[18]. Oocyt II rzędu natychmiast przekształca się w ootydę, by stać się dojrzałą komórką jajową, mierzącą około 0,2 mm średnicy[23].
Spośród dwóch jajników (prawego i lewego) owulacja przebiega losowo w jednym z nich, nie wiadomo nic o żadnej koordynacji tego zjawiska[24]. Okazjonalnie oba jajniki uwalniają oocyty[24]. Jeśli oba z nich ulegną zapłodnieniu, powstaną bliźnięta dwujajowe[25].
Po uwolnieniu z jajnika komórka jajowa dostaje się do jajowodu dzięki fimbriom, frędzlowatym wypustkom tkankowym wieńcącym ujście brzuszne jajowodu. Po okoł dniu niezapłodnione jajo ulega dezintegracji w jajowodzie[18].
Zapłodnienie przez plemnik, jesli zachodzi, zazwyczaj odbywa się w bańce jajowodu, najszerszej części tego narządu. Zapłodnione jajo rozpoczya proces embriogenezy. Rozwijające się zarodek po około trzech dniach osiąga jamę macicy, a po kolejnych trzech ulega implantacji w endometrium[18]. Na tym etapie rozwoju osiąga zwykle stadium blastocysty.
U niektórych kobiet owulacja wiąże się z bólem nazywanym z niemieckiego mittelschmerz ("ból środkowy")[26]. Nagłe zmiany hormonaln w czasie owulacji czasami powodują również nieznacze krwawienie w środku cyklu[27].
Faza lutealna
[edytuj | edytuj kod]Faza lutealna kończy cykl jajnikowy, koresponduje też z fazą sekrecyjną cyklu macicznego. Podczas fazy lutealnej gonadotropiny przysadkowe FSH i LH powodują przekształcenie się pozostałości domunijącego pęherzyka jajnikowego w ciałko żółte, które produkuje progesteron. Wzrost stężenia tego hormonu indukuje syntezę estrogenu. Hormony tworzone w ciałku żółtym wywołują również supresję produkcji FSH i LH, których ciałko żółte potrzebuje do kontynuowania swego istnienia. W rezultacie następuje szybki spadek stężeń gonadotropin, po czym ciałko żółte ulega zanikowi[18]. Spadek poziomu progesteronu wywołuje miesiączkę i rozpoczęcie się kolejnego cyklu. Od czasu owulacji do spadku stężenia progesteronu wywołującego menstruację mijają typowo około 2 tygodnie, za normalną długość uważa się 14 dni. U konkretnych kobiet faza foikularna często ma zmienną długość z cyklu na cykl, a dla odmiany długość fazy lutealnej utrzymuje się taka sama[28].
Utracie ciałka żółtego zapobiega zapłodnienie oocytu. Syncytiotrofoblast, stanowiący zewnętrzną warstwę zawierającej w środku zarodek blastocysty, a później tworzący zewnętrzną warstwę łożyska, wytwarza gonadotropinę kosmówkową (hCG), bardzo podobną do LH, która zachowuje ciałko żółte. Wobec tego to ostantnie może kontynuować produkcję pregesteronu, by utrzymać nową ciążę. Większość testów ciążowych wykrywa właśnie obecność hCG[18].
Cykl maciczny
[edytuj | edytuj kod]Miesiączka
[edytuj | edytuj kod]Miesiączka, zwana też menstruacką, okresem, krwawieniem miesięcznym, rozpoczyna cykl maciczny. Wypływ krwi miesięcznej sygnalizuje normalnie, że kobieta nie jest w ciąży (jednakże zaobserwowanie krwawienia nie daje takiej pewności, jako że liczne czynniki mogą powodować krwawienie podczas ciąży, niektóre z nich zaś są specyficzne dla pierwszego trymestru ciąży; niektóre spowodować mogą znaczny krwotok)[29][30][31].

Eumenorrhea oznacza normalną, regularną miesiączkę trwającą kilka dni, zazwyczaj od 3 do 5, jakkolwiek za normę uznaje się czas trwania od 2 do 7 dni[26][32]. Średnia utrata krwi podczas menstruacji wynosi 35 mililitrów, norma wynosi 10–80 ml[33]. Kobiety doświadczające menorrhagii są bardziej narażone na niedobór żelaza[34]. Enzym zwany plazminą hamuje krzepnięcie krwi w płynie menstruacyjnym[35].
Bolesne skurcze brzucha, pleców bądź proksymalnej części ud częśto zdarzają się podczas pierwszych dni miesiączki. Ciężki ból macicy podczas menstruacji określa się mianem dysmenorrhei. Wyswtępuje najczęściej wśród nastolatek i młodszych kobiet (cierpi nań 67,2% nastolatek)[36]. Z początkiem menstruacji objawy zespołu napięcia przedmiesiączkowego, jak tkliwość sutków czy drażliwość, generalnie zmniejszają się[26].
Faza proliferacyjna
[edytuj | edytuj kod]Faza proliferacyjna następuje po miesiączce w cyklu macicznym. Estrogeny powodują w jej trakcie wzrost i proliferację wyściółki macicy[18]. Gdy dojrzeją, pęcherzyki jajnikowe wydzielają wzrastające ilości estrogenów. Hormony te rozpoczynają tworzenie nowej warstwy endometrium. Estrogen stymuluje także krypty szyjkowe do produkcji śluzu szyjkowego[37].
Faza wydzielnicza
[edytuj | edytuj kod]Faza wydzielnicza kończy cykl maciczny, odpowiadając fazie lutealnej cyklu jajnikowego. W jej trakcie ciałko żółte wydziela progesteron, odgrywający kluczową roę w wytworzeniu zdolności emdometrium do przyjęcia implantującej się blastocysty i wspierania wczesnej ciąży poprzez wzrost przepływu krwi, większe wydzielanie i zmniejszenie kurczliwości miometrium[38]. Efektem ubocznym jest podwyższenie się podstawowej temperatury ciała kobiety[39].
Długość
[edytuj | edytuj kod]Średnia długość trwania cyklu miesiączkowego wynosi 28 dni. Zmienność długości cyklu jest największa u kobiet poniżej 25 lat życia, najmniejsze wartości osiąga zaś w wieku 35-39 lat, kiedy cykle są najbardziej regularne[40]. następnie zmienność zwiększa się nieznacznie w wieku 40-44 lata[40]. Zazwyczaj zmienność długości pomiędzy 8 a 20 dniami jest u kobiety określana mianem umiarkowanie nieregularnych cykli miesiączkowych[13]. Zmienność większa lub równa 21 dni oznacza, że cykle są bardzo nieregularne[13].
Zgodnie z pomiarami wykonanymi u kobiet przechodzących procedurę zapłodnienia in vitro, dłuższy cykl miesiączkowy wiąże się z wyższymi szansami na ciążę i poród, nawet po uzwględnieniu poporawki na wiek[41]. Współczynnik określający szanse na poród IVF wedle szacunków jest prawie dwukrotnie wiekszy u kobieto cyklu trwającym powyżej 34 dni w porównaniu z tymi o cyklu krótszym od 26 dni[41]. Dłuższy cykle misiączkowy wiąże się także silnie z lepszą odpowiedzią jajnika na stymulację gonadotropinową i jakością zarodków[41].
Faza lutealna cyklu miesiączkowego jest prawie tej samej długości u większości badanych (średnio 14/13 dni, oschylenie standardowe 1,41 dnia)[42], podczas gdy faza folikularna wykazuje znacznie większą zmienność (u 95% kobiet eży w przedziale 10,3-16,3 dni)[43]. Faza folikularna wydaje się także znacznie skracać z wiekiem. Średnia geometryczna wynosi 14,2 dnia u kobiet w wieku18-24 lata, 10,4 dnia zaś u kobiet z przedziału 40–44[43].
Okno płodne
[edytuj | edytuj kod]Okres największej płodności (a więc czas cechujący się największym prawdopodobieństwem ciąży po odbyciu stosunku płciowego) rozpoczyna się około 5 dni przed i trwa do 1-2 dni po owulacji[44].
Metody regulacji płodności bazujące tylko na długości cyklu to kalendarzyk małżeński[45]. Metody wymagające obserwacji przynajmniej jednej z trzech głównych oznak płodności (podstawowa temperatura ciała, śluz szyjkowy i pozycja szyjki)[46] zaliczają się do metod rozpoznawania płodności[45]. Dostępne są również zestawy do badania moczu, wykrywające pik LH, która pojawia się między 24 a 36 godzin przed owulacją[47].
Płodność kobiety zależy także od jej wieku[48].
Inne układy
[edytuj | edytuj kod]Wiele kobiet cierpiących na padaczkę wykazuje związek napadów drgawkowych z fazą cyklu miesiączkowego, co po angielsku zwie się "catamenial epilepsy"[49]. Wydają sie istnieć różne wzorce. Drgawki mogą występować w czasie miesiączki bądź w czasie owulacji. Częstości, z jaką się pojawiają, nie ustalono w sposób pewny. Wykorzystując jedną z definicji, grupa naukowców stwierdziła u około jednej trzeciej kobiet cierpiących na oporną na leczenie padaczkę częściową catamenial epilepsy[49][50][51]. Proponowano również efekty działania hormonów. Spadek stężenia progenteronu i wzrost estrogenów miały wywoływać drgawki[52]. Kobiety miesiączkujące mają 1,68 raza wyższe ryzyko samobójstwa[53].
Jako model doświadczalny w badaniach nad możliwymi mechanizmami wykorzystano myszy. Oceniano wpływ stężeń steroidów płciowych na regulację układu nerwowego. Podczas części mysiego cyklu rujowego, kiedy poziom progesteronu był najwyższy, poziom receptora gabaergicznego podtypu delta na neuronach był wysoki. Jako że pobudzenie tego receptora skutkuje hamowaniem czynności neuronalnej, neurony bogatsze w GABAR δ będą mniej skłonne do czynności napadowej, niż te uboższe w omawiane receptory. Podczas fazy cyklu rujowego o przewadze stężeń estrogenów nad progesteronem ilość rzeczonych receptorów GABA zmniejsza się, zwieksza się wobec tego aktywność neuronów, co zwiększa niepokój i podatność na drgawki[54].
Poiom estrogenów wpływa na pracę tarczycy[55]. Przykładowo podczas fazy lutealnej (kiedy stężenia estrogenów są niskie) szybkość przepływu krwi przez tarczycę jest niższa, iż podczas fazy fokikularnej (cechującej się wysokimi poziomami estrogenów)[56].
Postulwano niegdyś, że wśród kobiet żyjących razem początek menopauzy synchronizuje się. Efekt ten opisano po raz pierwszy w 1971. Wyjaśniano go działaniem fermonów w 1998.[57]. Kolejne badania zakwestionowały taką hipotezę[58].
Badania wskazują, że kobietom grozi znacznie wyższe ryzyko urazu więzadła krzyżowego przedniego w okresie przedowulacyjnym, niż w poowulacyjnym[59].
Nastrój i zachowanie
[edytuj | edytuj kod]Różne fazy cyklu miesiączkowego korelują z nastrojem kobiety. W pewnych przypadkach hormony wydzielane podczas cyklu mogą powodać zmiany behawioralne u kobiet, pojawiają się łagodne bądź wyraźniejsze zmiany nastroju[60]. Faza cyklu miesiączkowego i hormony wydzielane przez jajniki mogą wpływać na zwiększenie empatii u kobiet. Naturalne zmiany poziomu hormonów w różnych fazach cyklu zbadano w połączeniu z wynikami testów. Kobiety w fazie folikularnej osiągały w nich lepsze wyniki, niż kobiety w środku fazy lutealnej. Znaleziono znaczącą korelację pomiędzy poziomem progesteronu a umiejętnością właściwego rozpoznawania emocji. Wyniki w testach rozpoznawania emocji były lepsze, gdy stężenie progesteronu były niskie. Kobiety w fazie folikularnej lepiej rozpoznawały emocje, niż ośrodku fazy lutealnej. Kobiety w wiekszym stopniu reagowały na negatywne bodźce w środku fazy lutealnej, niż w fazie folikularnej, może się to wiązać z większą reaktywnością społeczną w tej fazie cyklu[61].
Zbadano również reakcję kobiet na strach w różnych fazach cyklu. Przy najwyższych stężeniach estrogenów przed owulacją kobiety lepiej identyfikują ekspresjęstrachu, niż kobiety w trakcie miesiączki, kiedy poziom estrogenów jest najniższy. Identyfikacja radosnych twarzy nie różniła się, co wskazuje, że strach jest silniejszytm bodźcem. Tak więc faza cyklu i poziom estrogenów korelue z reakcję na strach u kobiet[62].
Jednak badanie codziennego nastroju u kobiet z pomiarami hormonów jajnikowych może wskazywać na mniej silne powiązanie. W porównaniu z poziomem stresu czy zdrowia fizycznego hormony jajnikowe wywierały mniejszy wpływ na nastrój[63].
Cycle abnormalities and disorders
[edytuj | edytuj kod]Infrequent or irregular ovulation is called oligoovulation[64]. The absence of ovulation is called anovulation. Normal menstrual flow can occur without ovulation preceding it: an anovulatory cycle. In some cycles, follicular development may start but not be completed; nevertheless, estrogens will be formed and stimulate the uterine lining. Anovulatory flow resulting from a very thick endometrium caused by prolonged, continued high estrogen levels is called estrogen breakthrough bleeding. Anovulatory bleeding triggered by a sudden drop in estrogen levels is called changes[65]. Anovulatory cycles commonly occur before menopause (perimenopause) and in women with polycystic ovary syndrome[66].
Very little flow (less than 10 ml) is called hypomenorrhea. Regular cycles with intervals of 21 days or fewer are polymenorrhea; frequent but irregular menstruation is known as metrorrhagia. Sudden heavy flows or amounts greater than 80 ml are termed menorrhagia[67]. Heavy menstruation that occurs frequently and irregularly is menometrorrhagia. The term for cycles with intervals exceeding 35 days is oligomenorrhea[68]. Amenorrhea refers to more than three[67] to six[68] months without menses (while not being pregnant) during a woman's reproductive years.
George Preti, an organic chemist at the Monell Chemical Senses Center in Philadelphia and Winnefred Cutler of the University of Pennsylvania's psychology department, discovered that women with irregular menstrual cycles became regular when exposed to male underarm extracts[69]. They hypothesized that the only explanation was that underarms contain pheromones, as there was no other explanation for the effects, which mirrored how pheromones affect other mammals[69].
Ovulation suppression
[edytuj | edytuj kod]Hormonal contraception
[edytuj | edytuj kod]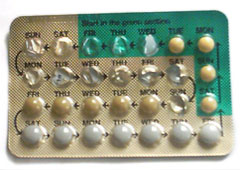
While some forms of birth control do not affect the menstrual cycle, hormonal contraceptives work by disrupting it. Progestogen negative feedback decreases the pulse frequency of gonadotropin-releasing hormone (GnRH) release by the hypothalamus, which decreases the release of follicle-stimulating hormone (FSH) and luteinizing hormone (LH) by the anterior pituitary. Decreased levels of FSH inhibit follicular development, preventing an increase in estradiol levels. Progestogen negative feedback and the lack of estrogen positive feedback on LH release prevent a mid-cycle LH surge. Inhibition of follicular development and the absence of a LH surge prevent ovulation[70][71][72].
The degree of ovulation suppression in progestogen-only contraceptives depends on the progestogen activity and dose. Low dose progestogen-only contraceptives—traditional progestogen only pills, subdermal implants Norplant and Jadelle, and intrauterine system Mirena—inhibit ovulation in about 50% of cycles and rely mainly on other effects, such as thickening of cervical mucus, for their contraceptive effectiveness[73]. Intermediate dose progestogen-only contraceptives—the progestogen-only pill Cerazette and the subdermal implant Nexplanon—allow some follicular development but more consistently inhibit ovulation in 97–99% of cycles. The same cervical mucus changes occur as with very low-dose progestogens. High-dose, progestogen-only contraceptives—the injectables Depo-Provera and Noristerat—completely inhibit follicular development and ovulation[73].
Combined hormonal contraceptives include both an estrogen and a progestogen. Estrogen negative feedback on the anterior pituitary greatly decreases the release of LH, which makes combined hormonal contraceptives more effective at inhibiting follicular development and preventing ovulation. Estrogen also reduces the incidence of irregular breakthrough bleeding[70][71][72]. Several combined hormonal contraceptives—the pill, NuvaRing, and the contraceptive patch—are usually used in a way that causes regular withdrawal bleeding. In a normal cycle, menstruation occurs when estrogen and progesterone levels drop rapidly[39]. Temporarily discontinuing use of combined hormonal contraceptives (a placebo week, not using patch or ring for a week) has a similar effect of causing the uterine lining to shed. If withdrawal bleeding is not desired, combined hormonal contraceptives may be taken continuously, although this increases the risk of breakthrough bleeding.
Lactational amenorrhea
[edytuj | edytuj kod]Breastfeeding causes negative feedback to occur on pulse secretion of gonadotropin-releasing hormone (GnRH) and luteinizing hormone (LH). Depending on the strength of the negative feedback, breastfeeding women may experience complete suppression of follicular development, follicular development but no ovulation, or normal menstrual cycles may resume[74]. Suppression of ovulation is more likely when suckling occurs more frequently[75]. The production of prolactin in response to suckling is important to maintaining lactational amenorrhea[76]. On average, women who are fully breastfeeding whose infants suckle frequently experience a return of menstruation at fourteen and a half months postpartum. There is a wide range of response among individual breastfeeding women, however, with some experiencing return of menstruation at two months and others remaining amenorrheic for up to 42 months postpartum[77].
Etymological and biological associations
[edytuj | edytuj kod]Nightlighting and the moon
[edytuj | edytuj kod]The word "menstruation" is etymologically related to "moon". The terms "menstruation" and "menses" are derived from the Latin mensis (month), which in turn relates to the Greek mene (moon) and to the roots of the English words month and moon[78].
Some authors believe that, historically, women in traditional societies without nightlighting ovulated with the full moon and menstruated with the new moon[79] and one author documents the controversial attempts to use the association to improve the rhythm method of regulating conception[78].
Some studies in both humans[80] and other animals[81] have found that artificial light at night does influence the menstrual cycle in humans and the estrus cycle in mice (cycles are more regular in the absence of artificial light at night). It has also been suggested that bright light exposure in the morning promotes more regular cycles[82]. One author has suggested that sensitivity of women's cycles to nightlighting is caused by nutritional deficiencies of certain vitamins and minerals[83].
A meta-analysis of studies from 1996 showed no correlation between the human menstrual cycle and the lunar cycle[84][85][86][87][88][89] Dogon villagers did not have electric lighting and spent most nights outdoors, talking and sleeping; so they were an ideal population for detecting a lunar influence; none, however, was found[90].
Przypisy
[edytuj | edytuj kod]- ↑ a b c d e Human Physiology: An Integrated Approach. Wyd. 6th. Glenview, IL: Pearson Education, Inc., 2013, s. 850–890. ISBN 0-321-75007-1.
- ↑ Human Physiology: From Cells to Systems. Wyd. 8th. Belmont, CA: Cengage, 2013, s. 735–794. ISBN 1-111-57743-9.
- ↑ Vander's Human Physiology: The Mechanism of Body Function. Wyd. 12th. New York, NY: McGrawHill, 2010, s. 555–631. ISBN 0-077-35001-4.
- ↑ Klump KL, Keel PK, Racine SE, et al.. The interactive effects of estrogen and progesterone on changes in emotional eating across the menstrual cycle. „J Abnorm Psychol”. 122 (1), s. 131–7, February 2013. DOI: 10.1037/a0029524. PMID: 22889242.
- ↑ Anderson SE, Dallal GE, Must A. Relative weight and race influence average age at menarche: results from two nationally representative surveys of US girls studied 25 years apart. „Pediatrics”. 111 (4 Pt 1), s. 844–50, April 2003. DOI: 10.1542/peds.111.4.844. PMID: 12671122.
- ↑ Al-Sahab B, Ardern CI, Hamadeh MJ, Tamim H. Age at menarche in Canada: results from the National Longitudinal Survey of Children & Youth. „BMC Public Health”. 10, s. 736, 2010. DOI: 10.1186/1471-2458-10-736. PMID: 21110899. PMCID: PMC3001737.
- ↑ Hamilton-Fairley, Diana: Lecture notes on obstetrics and gynaecology. Wyd. 2nd. Blackwell, 2004, s. 29. ISBN 1-4051-2066-5.
- ↑ Macgússon TE. Age at menarche in Iceland. „Am. J. Phys. Anthropol.”. 48 (4), s. 511–4, May 1978. DOI: 10.1002/ajpa.1330480410. PMID: 655271.
- ↑ At what age does a girl get her first period?. [dostęp 20 November 2011].
- ↑ Clinical topic - Menopause. [w:] NHS [on-line]. [dostęp 2 November 2009].
- ↑ Yewoubdar Beyene: From Menarche to Menopause: Reproductive Lives of Peasant Women in Two Cultures. Albany, NY: State University of New York Press, 1989. ISBN 0-88706-866-9.
- ↑ Tracy Shuman: Your Guide to Menopause. [w:] WebMD [on-line]. February 2006. [dostęp 16 December 2006].
- ↑ a b c John Kippley, Sheila Kippley: The Art of Natural Family Planning. Wyd. 4th. Cincinnati: The Couple to Couple League, 1996, s. 92. ISBN 978-0-926412-13-2.
- ↑ Maila Ager: Mandatory menstruation leave measure filed in House. Inquirer.net, 18 August 2008. [dostęp 16 June 2011].
- ↑ Toyin Owoseje: Menstruation Leave: Russian Lawmaker Proposes Paid Days Off For Women Employees on Period. 31 July 2013. [dostęp 3 January 2014].
- ↑ Sarah Iuliano: Menstrual leave: delightful or discriminatory?. [w:] 5 August 2013 [on-line]. Lip Magazine. [dostęp 3 January 2014].
- ↑ Catherine Price: Should women get paid menstruation leave?. 11 October 2006. [dostęp 3 January 2014].
- ↑ a b c d e f g h i Biology. New York: McGraw-Hill, 2002, s. 1207–09. ISBN 0-07-303120-8.
- ↑ Ovulation Test at Duke Fertility Center. Retrieved 2 July 2011
- ↑ Ovulation Calender. Pregnology.
- ↑ a b c Gretchen M Lentz: Comprehensive gynecology.. St. Louis: Elsevier Mosby, 2013. ISBN 978-0-323-06986-1. [dostęp 5 April 2012].
- ↑ Hu L, Gustofson RL, Feng H, et al.. Converse regulatory functions of estrogen receptor-alpha and -beta subtypes expressed in hypothalamic gonadotropin-releasing hormone neurons. „Mol. Endocrinol.”. 22 (10), s. 2250–9, October 2008. DOI: 10.1210/me.2008-0192. PMID: 18701637. PMCID: PMC2582533.
- ↑ The Ovum. W: Gray, Henry David: Anatomy of the human body. Philadelphia: Bartleby.com, 2000. ISBN 1-58734-102-6.
- ↑ a b Ecochard R, Gougeon A. Side of ovulation and cycle characteristics in normally fertile women. „Hum. Reprod.”. 15 (4), s. 752–5, April 2000. DOI: 10.1093/humrep/15.4.752. PMID: 10739814.
- ↑ Multiple Pregnancy: Twins or More - Topic Overview. [w:] WebMD Medical Reference from Healthwise [on-line]. 24 July 2007. [dostęp 5 October 2008].
- ↑ a b c John M Goldenring: All About Menstruation. WebMD, 1 February 2007. [dostęp 5 October 2008].
- ↑ Weschler (2002), s.65
- ↑ Weschler (2002), p.47
- ↑ Marjorie Greenfield: Subchorionic Hematoma in Early Pregnancy. [w:] Ask Our Experts [on-line]. 17 September 2001. [dostęp 21 September 2008].
- ↑ Ann L Anderson-Berry, Terence Zach. Vanishing Twin Syndrome. „Emedicine.com”, 10 December 2007. WebMD. [dostęp 21 September 2008].
- ↑ Patrick Ko, Young Yoon. Placenta Previa. „Emedicine.com”, 23 August 2007. WebMD. [dostęp 21 September 2008].
- ↑ Menstruation and the Menstrual Cycle. Womenshealth.gov, April 2007.
- ↑ David L Healy: Menorrhagia Heavy Periods - Current Issues. Monash University, 24 November 2004. ABN 12 377 614 012.
- ↑ Harvey LJ, Armah CN, Dainty JR, et al.. Impact of menstrual blood loss and diet on iron deficiency among women in the UK. „Br. J. Nutr.”. 94 (4), s. 557–64, October 2005. DOI: 10.1079/BJN20051493. PMID: 16197581.
- ↑ Shiraishi M. Studies on identification of menstrual blood stain by fibrin-plate method. I. A study on the incoagulability of menstrual blood. „Acta Med Okayama”. 16, s. 192–200, August 1962. PMID: 13977381.
- ↑ Sharma P, Malhotra C, Taneja DK, Saha R. Problems related to menstruation amongst adolescent girls. „Indian J Pediatr”. 75 (2), s. 125–9, 2008-02. DOI: 10.1007/s12098-008-0018-5. PMID: 18334791.
- ↑ Toni Weschler: Taking Charge of Your Fertility. Wyd. Revised. New York: HarperCollins, 2002, s. 359–361. ISBN 0-06-093764-5.
- ↑ Lombardi, Julian: Comparative Vertebrate Reproduction. Springer, 1998, s. 184. ISBN 978-0-7923-8336-9.
- ↑ a b Weschler (2002), pp.361-2
- ↑ a b Chiazze L, Brayer FT, Macisco JJ, Parker MP, Duffy BJ. The length and variability of the human menstrual cycle. „JAMA”. 203 (6), s. 377–80, 1968-02. DOI: 10.1001/jama.1968.03140060001001. PMID: 5694118.
- ↑ a b c Menstrual cycle length is an age-independent marker of female fertility: Results from 6271 treatment cycles of in vitro fertilization. „Fertility and Sterility”. 90 (5), s. 1656–1661, 2008. DOI: 10.1016/j.fertnstert.2007.09.036. PMID: 18155201.
- ↑ Lenton EA, Landgren BM, Sexton L. Normal variation in the length of the luteal phase of the menstrual cycle: identification of the short luteal phase. „Br J Obstet Gynaecol”. 91 (7), s. 685–9, 1984-07. DOI: 10.1111/j.1471-0528.1984.tb04831.x. PMID: 6743610.
- ↑ a b Lenton EA, Landgren BM, Sexton L, Harper R. Normal variation in the length of the follicular phase of the menstrual cycle: effect of chronological age. „Br J Obstet Gynaecol”. 91 (7), s. 681–4, July 1984. DOI: 10.1111/j.1471-0528.1984.tb04830.x. PMID: 6743609.
- ↑ Weschler (2002), pp.242,374
- ↑ a b Medical Eligibility Criteria for Contraceptive Use:Fertility awareness-based methods. , 2004. World Health Organization. [dostęp 29-04-2008].
- ↑ Weschler (2002), p.52
- ↑ MedlinePlus Encyclopedia LH urine test (home test)
- ↑ Leridon H. Can assisted reproduction technology compensate for the natural decline in fertility with age? A model assessment. „Hum. Reprod.”. 19 (7), s. 1548–53, July 2004. DOI: 10.1093/humrep/deh304. PMID: 15205397.
- ↑ a b Herzog AG. Catamenial epilepsy: definition, prevalence pathophysiology and treatment. „Seizure”. 17 (2), s. 151–9, March 2008. DOI: 10.1016/j.seizure.2007.11.014. PMID: 18164632.
- ↑ Herzog AG, Harden CL, Liporace J, et al.. Frequency of catamenial seizure exacerbation in women with localization-related epilepsy. „Annals of Neurology”. 56 (3), s. 431–4, September 2004. DOI: 10.1002/ana.20214. PMID: 15349872.
- ↑ Herzog AG, Klein P, Ransil BJ. Three patterns of catamenial epilepsy. „Epilepsia”. 38 (10), s. 1082–8, October 1997. DOI: 10.1111/j.1528-1157.1997.tb01197.x. PMID: 9579954.
- ↑ Scharfman HE, MacLusky NJ. The influence of gonadal hormones on neuronal excitability, seizures, and epilepsy in the female. „Epilepsia”. 47 (9), s. 1423–40, September 2006. DOI: 10.1111/j.1528-1167.2006.00672.x. PMID: 16981857. PMCID: PMC1924802.
- ↑ Baca-García E, Diaz-Sastre C, Ceverino A, Saiz-Ruiz J, Diaz FJ, de Leon J. Association between the menses and suicide attempts: a replication study. „Psychosom Med”. 65 (2), s. 237–44, 2003. DOI: 10.1097/01.PSY.0000058375.50240.F6. PMID: 12651991.
- ↑ Maguire JL, Stell BM, Rafizadeh M, Mody I. Ovarian cycle-linked changes in GABA(A) receptors mediating tonic inhibition alter seizure susceptibility and anxiety. „Nat. Neurosci.”. 8 (6), s. 797–804, June 2005. DOI: 10.1038/nn1469. PMID: 15895085.
- ↑ Doufas AG, Mastorakos G. The hypothalamic-pituitary-thyroid axis and the female reproductive system. „Annals of the New York Academy of Sciences”. 900, s. 65–76, 2000. DOI: 10.1111/j.1749-6632.2000.tb06217.x. PMID: 10818393.
- ↑ Krejza J, Nowacka A, Szylak A, Bilello M, Melhem LY. Variability of thyroid blood flow Doppler parameters in healthy women. „Ultrasound Med Biol”. 30 (7), s. 867–76, July 2004. DOI: 10.1016/j.ultrasmedbio.2004.05.008. PMID: 15313319.
- ↑ Stern K, McClintock MK. Regulation of ovulation by human pheromones. „Nature”. 392 (6672), s. 177–9, March 1998. DOI: 10.1038/32408. PMID: 9515961.
- ↑ Cecil Adams: Does menstrual synchrony really exist?. [w:] The Straight Dope [on-line]. 20 December 2002. [dostęp 10 January 2007].
- ↑ Renstrom P, Ljungqvist A, Arendt E, et al.. Non-contact ACL injuries in female athletes: an International Olympic Committee current concepts statement. „Br J Sports Med”. 42 (6), s. 394–412, June 2008. DOI: 10.1136/bjsm.2008.048934. PMID: 18539658.
- ↑ Schmidt PJ, Nieman LK, Danaceau MA, Adams LF, Rubinow DR. Differential behavioral effects of gonadal steroids in women with and in those without premenstrual syndrome. „N. Engl. J. Med.”. 338 (4), s. 209–16, January 1998. DOI: 10.1056/NEJM199801223380401. PMID: 9435325.
- ↑ Derntl B, Hack RL, Kryspin-Exner I, Habel U. Association of menstrual cycle phase with the core components of empathy. „Horm Behav”. 63 (1), s. 97–104, January 2013. DOI: 10.1016/j.yhbeh.2012.10.009. PMID: 23098806. PMCID: PMC3549494.
- ↑ Schwartz DH, Romans SE, Meiyappan S, De Souza MJ, Einstein G. The role of ovarian steroid hormones in mood. „Horm Behav”. 62 (4), s. 448–54, September 2012. DOI: 10.1016/j.yhbeh.2012.08.001. PMID: 22902271.
- ↑ Pearson R, Lewis MB. Fear recognition across the menstrual cycle. „Horm Behav”. 47 (3), s. 267–71, March 2005. DOI: 10.1016/j.yhbeh.2004.11.003. PMID: 15708754.
- ↑ Nicole Galan: Oligoovulation. 16 April 2008. [dostęp 12 October 2008].
- ↑ Weschler (2002), p.107
- ↑ Anovulation w bazie eMedicine (ang.)
- ↑ a b Menstruation Disorders w bazie eMedicine (ang.)
- ↑ a b Oriel KA, Schrager S. Abnormal uterine bleeding. „Am Fam Physician”. 60 (5), s. 1371–80; discussion 1381–2, October 1999. PMID: 10524483.
- ↑ a b Cathryn M. Delude: Looking for love potion number nine. [w:] Boston Globe [on-line]. 2 September 2003.
- ↑ a b Contraceptive Efficacy. W: Trussell, James: Contraceptive Technology. Wyd. 19th rev. New York: Ardent Media, 2007. ISBN 0-9664902-0-7.
- ↑ a b Oral Contraception. W: Speroff, Leon; Darney, Philip D.: A Clinical Guide for Contraception. Wyd. 4th. Philadelphia: Lippincott Williams & Wilkins, 2005, s. 21–138. ISBN 0-7817-6488-2.
- ↑ a b Estrogens and Progestins. W: Loose, Davis S.; Stancel, George M.: Goodman & Gilman's The Pharmacological Basis of Therapeutics. Wyd. 11th. New York: McGraw-Hill, 2006, s. 1541–71. ISBN 0-07-142280-3.
- ↑ a b Contraception. W: Anna Glasier: Endocrinology. Wyd. 5th. Philadelphia: Elsevier Saunders, 2006, s. 3000–1. ISBN 0-7216-0376-9.
- ↑ McNeilly AS. Lactational control of reproduction. „Reprod. Fertil. Dev.”. 13 (7–8), s. 583–90, 2001. DOI: 10.1071/RD01056. PMID: 11999309.
- ↑ John Kippley: The Art of Natural Family Planning. Wyd. 4th. Cincinnati, OH: The Couple to Couple League, 1996, s. 347. ISBN 0-926412-13-2.
- ↑ Stallings JF, Worthman CM, Panter-Brick C, Coates RJ. Prolactin response to suckling and maintenance of postpartum amenorrhea among intensively breastfeeding Nepali women. „Endocr. Res.”. 22 (1), s. 1–28, February 1996. DOI: 10.3109/07435809609030495. PMID: 8690004.
- ↑ Breastfeeding: Does It Really Space Babies?. [w:] The Couple to Couple League International [on-line]. 17 January 2008. [dostęp 21 September 2008]., which cites:
- Sheila K. and John F. Kippley. The relation between breastfeeding and amenorrhea. „Journal of obstetric, gynecologic, and neonatal nursing”. 1 (4), s. 15–21, November–December 1972. DOI: 10.1111/j.1552-6909.1972.tb00558.x. PMID: 4485271.
- Sheila Kippley. Breastfeeding survey results similar to 1971 study. „The CCL News”. 13 (3), s. 10, November–December 1986 and January–February 1987. and 13(4): 5.
- ↑ a b Allen, Kevin: The Reluctant Hypothesis: A History of Discourse Surrounding the Lunar Phase Method of Regulating Conception. Lacuna Press, 2007, s. 239. ISBN 978-0-9510974-2-7.
- ↑ Sari Cohen. Melatonin, menstruation, and the moon. „Townsend Letter for Doctors and Patients”, February–March 2005. [dostęp 21 September 2008].
, Chris Knight, Camilla Power and Ian Watts. The Human Symbolic Revolution: A Darwinian Account. „Cambridge Archaeological Journal”. 5 (1), s. 75–114, 1995. DOI: 10.1017/S0959774300001190. [dostęp 13 December 2006].
Lacey, Louise: Lunaception: a feminine odyssey into fertility and contraception. New York: Coward, McCann & Geoghegan, 1975. ISBN 0-698-10674-1. - ↑ Singer, Katie. "Fertility Awareness, Food, and Night-Lighting". Wise Traditions in Food, Farming and the Healing Arts, Spring 2004. See section on Night-Lighting.
- ↑ Harder, Ben. Bright nights kindle cancers in mice. „Science News”. 166 (9), s. 141, Week of 28 August 2004.
- ↑ Danilenko KV, Samoilova EA. Stimulatory Effect of Morning Bright Light on Reproductive Hormones and Ovulation: Results of a Controlled Crossover Trial. „PLoS clinical trials”. 2 (2), s. e7, 2007. DOI: 10.1371/journal.pctr.0020007. PMID: 17290302. PMCID: PMC1851732.
- ↑ Shannon, Marilyn M.: Fertility, cycles & nutrition : how your diet affects your menstrual cycles & fertility. Wyd. 3rd. Cincinnati, OH: Couple to Couple League International, 2001, s. 71–72.
- ↑ As cited by Adams, Cecil, "What's the link between the moon and menstruation?" (accessed 6 June 2006):
.George O. Abell: Science and the Paranormal: Probing the Existence of the Supernatural. Scribner Book Company, 1983. ISBN 0-684-17820-6. - ↑ Cutler WB. Lunar and menstrual phase locking. „Am. J. Obstet. Gynecol.”. 137 (7), s. 834–9, August 1980. PMID: 7405975.
- ↑ Friedmann E.. Menstrual and lunar cycles. „Am. J. Obstet. Gynecol.”. 140 (3), s. 350, June 1981. PMID: 7246643.
- ↑ Law SP. The regulation of menstrual cycle and its relationship to the moon. „Acta Obstet Gynecol Scand”. 65 (1), s. 45–8, 1986. DOI: 10.3109/00016348609158228. PMID: 3716780.
- ↑ Zimecki M.. The lunar cycle: effects on human and animal behavior and physiology. „Postepy Hig Med Dosw (Online)”. 60, s. 1–7, 2006. PMID: 16407788.
- ↑ Ivan Kelly, James Rotton, Roger Culver. The Moon Was Full and Nothing Happened: A Review of Studies on the Moon and Human Behavior. „Skeptical Inquirer”. 10 (2), s. 129–43, 1986.. Reprinted in The Hundredth Monkey - and other paradigms of the paranormal, edited by Kendrick Frazier, Prometheus Books. Revised and updated in The Outer Edge: Classic Investigations of the Paranormal, edited by Joe Nickell, Barry Karr, and Tom Genoni, 1996, CSICOP.
- ↑ Strassmann B. I.. The biology of menstruation in Homo sapiens: total lifetime menses, fecundity, and nonsynchrony in a natural fertility population. „Current Anthropology”. 38, s. 123–9, 1997. DOI: 10.1086/204592. JSTOR: 2744446.
[[Category:Menstrual cycle| ]] [[Category:Periodic phenomena]] {{Link FA|pt}} [[ta:மாதவிடாய்]] [[zh:月經]]