Радикал (хемија)
Радикали (слободни радикали) су атоми, молекули, или јони са неспареним електронима у спољашњој љуски.[1][2][3] Слободни радикали могу да буду позитивни, негативни, или без наелектрисања. Неспарени електрони дају радикалима хемијску реактивност. Сматра се да слободни радикали у телу један од узрока дегенеративних болести, старења и канцера.
Слободни радикали су значајни за сагоревање, атмосферску хемију, полимеризацију, хемију плазме, биохемију, и многе друге хемијске процесе. У хемијској биологији, супероксид и азот-моноксид регулишу мноштво процеса, као што је контрола васкуларног тона. Радикали могу да буду и гласници посредством феномена званог редокс сигнализација. Радикал може да буде заробљен унутар кавеза растварача, или да буду на неки други начин везани.
Хемијске реакције
[уреди | уреди извор]У хемијским једначинама, слободни радикали се често означавају тачком стављеном непосредно иза симбола атома:
- Гасовити хлор се може разложити ултравиолетном светлошћу чиме се формирају радикали хлора.
Реакциони механизми радикала користе једнострану стрелу за приказивање кретања електрона:
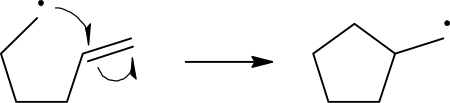
Хомолитичко раскидање везе се приказује стрелом која наликује куки за рибу, да би се направила разлика од уобичајеног кретања два електрона, што се приказује стандардном закривљеном стрелом. Треба напоменути да се други електрон раскидајуће везе такође помера да формира пар са нападујићем електроном радикала; то није експлицитно приказано у овом случају.
Слободни радикали узимају учешћа у адицији и супституцији радикала као реактивни интермедијари. Ланчане реакције у којима учествују слободни радикали се обично деле у три процеса.
- Реакције иницијације резултирају у повећању броја слободних радикала.
- Реакције пропагације су реакције у којима се тотални број слободних радикала не мења.
- Реакције терминације доводе до умањења броја слободних радикала. Типично два слободна радикала формирају стабилније врсте, нпр.: 2Цл·→ Цл2
Литература
[уреди | уреди извор]- ↑ Цлаyден Јонатхан, Ницк Греевес, Стуарт Wаррен, Петер Wотхерс (2001). Органиц цхемистрy. Оxфорд, Оxфордсхире: Оxфорд Университy Пресс. ИСБН 0-19-850346-6.
- ↑ Моррисон Роберт Тхорнтон, Боyд Роберт Неилсон (2006). Органиц цхемистрy. Енгелwоод Цлиффс, Неw Јерсеy: Прентице Халл. ИСБН 8120307658.
- ↑ Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.