Reacción de ciclación

El término ciclación o ciclización es un término genérico utilizado para describir reacciones químicas que producen el cierre de estructuras moleculares lineales o ramificadas, para formar anillos, y más específicamente a aquellas reacciones químicas que producen compuestos orgánicos cíclicos. El término se utiliza tanto para reacciones químicas producidas artificialmente como para reacciones químicas que se producen dentro de los seres vivos y también para aquellas reacciones que se producen espontáneamente.
Reacciones generales de formación de anillos
[editar]
Existen variedad limitada de reacciones especializadas que se pueden utilizar para producir compuestos cíclicos, sin embargo existe una gran variedad de reacciones orgánicas generales que pueden ser utilizadas para producir el cierre de anillos, y que históricamente han sido cruciales en el desarrollo, entendimiento y aplicación tecnológica de la química de los anillos. Dentro de este último campo el conocimiento de la química de los anillos ha permitido el desarrollo de procedimientos sustentables para la producción en grandes cantidades de estructuras cíclicas con sustituyentes y orientaciones estereoquímicas específicas.
Dentro de las reacciones generales se pueden citar, por ejemplo:
- La condensación aciloínica
- Las oxidaciones anódicas
- La condensación de Dieckmann aplicada a la formación de anillos.
Reacciones de cierre de anillos
[editar]En la química orgánica, existen una variedad de procedimientos sintéticos que resultan particularmente útiles para mediar el cierre de anillos carbocíclicos y otras clases de anillos; en términos generales se denomina a estas reacciones como reacciones de cierre de anillos. Algunos ejemplos de estas reacciones son:
- La trimerización de alquinos, una reacción utilizada para formar compuestos aromáticos;
- La ciclación de Bergman;
- La reacción de Diels-Alder y otras reacciones de cicloadición;
- La reacción de ciclización de Nazarov;
- Varias reacciones de ciclación por radicaes;
- Reacciones de Metátesis de cierre de anillo, las cuales también pueden ser utilizadas para producir tipos específicos de polimerización por apertura de anillos;
- La síntesis de grandes anillos de Ruzicka; y
- La síntesis de aziridinas de Wenker.
Ciclación de monosacáridos
[editar]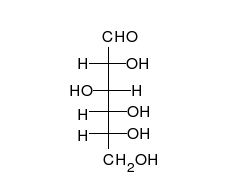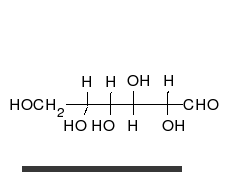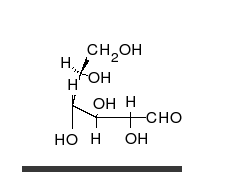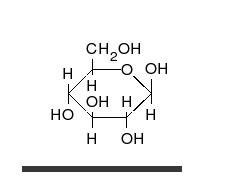
La reacción de ciclación de un glúcido es un tipo de reacción química espontánea que se produce cuando el grupo aldehído o cetona en la cadena lineal abierta de un monosacárido reacciona reversiblemente con el grupo hidroxilo sobre un átomo de carbono diferente en la misma molécula para formar un hemiacetal o hemicetal. En este tipo de reacción se forma un anillo heterocíclico, con un puente de oxígeno entre los dos átomos de carbono. Los anillos con cinco y seis átomos son llamados formas furanosa y piranosa y existen en equilibrio con la cadena lineal abierta.
Durante la conversión de la forma lineal abierta a la forma cíclica, el átomo de carbono que contiene el oxígeno carbonilo, llamado el carbono anomérico, se transforma en un centro quiral con dos posibles configuraciones: el átomo de oxígeno puede tomar una posición arriba o abajo del plano del anillo. El par de estereoisómeros resultantes son llamados anómeros. En el α-anómero, el -OH sustituyente sobre el carbono anomérico se encuentra en el lado opuesto del anillo (posición trans) a la cadena CH2OH. La forma alternativa, en la cual el sustituyente CH2OH y el grupo hidroxilo sobre el carbono anomérico están en el mismo lado (posición cis) del plano del anillo, es llamado β-anómero. Como el anillo y la forma abierta se interconvierten, ambos anómeros existen en equilibrio.
Bibliografía
[editar]- Jürgen-Hinrich Fuhrhop & Gustav Penzlin (1986). Organic synthesis: concepts, methods, starting materials. Weinheim, BW, DEU:VCH. ISBN 0895732467..
- Michael B. Smith & Jerry March (2007). March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6ta edición). New York, NY, USA: Wiley & Sons. ISBN 0470084944.
- Francis A. Carey & Richard J. Sundberg (2006). Title Advanced Organic Chemistry: Part A: Structure and Mechanisms (4th edición). New York, NY, USA: Springer Science & Business Media. ISBN 0306468565..
- Jonathan Clayden, Nick Greeves & Stuart Warren (2012). Organic Chemistry. Oxford, Oxon, GBR: Oxford University Press. ISBN 0199270295..
- László Kürti & Barbara Czakó (2005). Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Amsterdam, NH, NLD: Elsevier Academic Press. ISBN 0124297854..