Autodysocjacja wody
Autodysocjacja wody lub autoprotoliza wody – samorzutna autodysocjacja cząsteczek wody pozostających w stanie ciekłym. Proces ten ma duże znaczenie praktyczne – decyduje m.in. o zdolności wody do rozpuszczania substancji jonowych a stała równowagi tej reakcji stanowi podstawę skali pH.



Przebieg reakcji autodysocjacji wody:
- H2O + H2O ⇌ H3O+ + OH−
Stałe reakcji
edytujZaniedbując aktywności, stałą równowagi tej reakcji można zdefiniować wzorem:
W warunkach standardowych ma ona wartość 3,23×10−18 co w praktyce oznacza, że jest ona bardzo silnie przesunięta w stronę substratu, czyli niezdysocjowanej formy wody. W idealnie czystej wodzie w warunkach standardowych stężenie jonów [H3O]+ i [OH]− wynosi ok. 10−7 mol/l[1].
Stała kwasowa dana wzorem:
- Ka = Keq[H2O] = ([H3O+][OH−])/[H2O]
- gdzie [H2O] ≈ 55,6 mol/dm3
ma w warunkach standardowych wartość 1,8×10−16[2].
Podane powyżej wartości otrzymane są przy użyciu stężenia molowego wody. Wartości numeryczne tych stałych byłyby znacząco inne w przypadku użycia aktywności rozpuszczalnika zamiast jego stężenia, ponieważ aktywność czystego rozpuszczalnika jest w termodynamice chemicznej zwykle przyjmowana jako równa jedności, podczas gdy stężenie molowe czystej wody wynosi około 55,6 mol/l.
Iloczyn jonowy wody
edytujW przypadku rozcieńczonych roztworów wodnych można przyjąć, że stężenie molowe niezdysocjowanej formy wody jest stałą, a aktywność czystego rozpuszczalnika wynosi 1. Obserwacja ta stanowi podstawę definicji iloczynu jonowego wody. Zaniedbując aktywności:
- Kw = Ka[H2O] = K(dys, w)[H2O]2 = [H3O+][OH−]
Wartość iloczynu jonowego wody w temperaturze pokojowej wynosi ok. 10−14.
Podobnie jak dla innych bardzo małych wartości wywodzących się z definicji stałej równowagi, jak iloczyn rozpuszczalności czy stała dysocjacji lub przy określaniu stężenia jonów hydroniowych oraz wodorotlenowych, wartość iloczynu jonowego podaje się jako −log10Kw (p jest operatorem oznaczającym obliczenie −log10):
- pKw = −log10Kw
Wartość pKw ≈ 14 (w temperaturze pokojowej).
W innych temperaturach/ciśnieniach
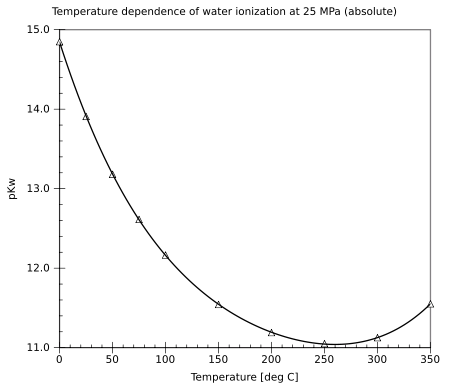
edytujPrzy normalnym ciśnieniu atmosferycznym woda jest ciekła w zakresie 0–100 °C. Wraz ze wzrostem temperatury dysocjacja staje się łatwiejsza (reakcja endotermiczna) i iloczyn jonowy Kw rośnie, a pKw spada. Wartość pKw zmienia się od ok. 14,95 w temperaturze 0 °C przez 14,0 (25 °C) i 13,0 (60 °C) do 11,25 w temperaturze 100 °C. W mniejszym stopniu, iloczyn jonowy wody zależy również od ciśnienia (zwiększona dysocjacja przy wyższym ciśnieniu). W warunkach podwyższonego ciśnienia, woda może pozostać ciekła aż do temperatury krytycznej. Iloczyn jonowy ciekłej wody zwiększa się ze zwiększającą się temperaturą aż do temperatury około 260 °C, a potem spada. Właściwości kwasowo-zasadowe wody w szerokim zakresie temperatur i ciśnień mają duże znaczenie praktyczne (na przykład, korozja w elektrowniach).
Związek z pH
edytujWartość pKw ma kluczowe znaczenie dla definicji skali pH. Między pH i pKw występuje zależność:
- pH + pOH = pKw
W idealnie czystej wodzie stężenia jonów [OH]− i [H3O]+ są sobie równe, stąd:
oraz (po zlogarytmowaniu obu stron):
- pH = pOH = ½pKw
Wartość pH = pOH w czystej wodzie, tzw. pH neutralne, wynosi 7,00 (25 °C, ciśnienie absolutne 100 kPa) i określa umowny środek skali pH25 °C. Generalnie, wartość neutralnego pH zależy od temperatury (i w mniejszym stopniu od ciśnienia) i jest równe ½pKw.
Zobacz też
edytujPrzypisy
edytuj- ↑ 2. Równowagi chemiczne. W: Douglas A. Skoog, Donald M. West, James F. Holler i Stanley R. Crouch: Podstawy Chemii Analitycznej. T. 1. Warszawa: Wydawnictwo Naukowe PWN, 2006, s. 232. ISBN 978-83-01-14885-0.
- ↑ John McMurry: Chemia organiczna. Wyd. 3. T. 1. Warszawa: PWN, 2005, s. 45–46. ISBN 83-01-14406-8.