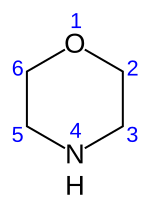
Morfolin
Morfolin je organsko hemijsko jedinjenje sa hemijskom formulom O (CH2CH2)2NH.[2] Ovo heterociklično jedinjenje, sadrži aminsku i etarsku funkcionalnu grupu. Aminska grupa daje morfolinu bazni karakter. Njegova konjugovana kiselina se naziva morfolinijum. Neutralizacijin morfolina sa hlorovodoničnom kiselinom nastaje so morfolinijum hlorid.
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
morfolin
| |||
| Drugi nazivi
Dietilenimid Oksid
1,4-oksazinan tetrahidro-1,4-oksazin | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ECHA InfoCard | 100.003.469 | ||
| RTECS | QD6475000 | ||
| |||
| Svojstva | |||
| C4H9NO | |||
| Molarna masa | 87,1 g/mol | ||
| Agregatno stanje | Bezbojna tečnost | ||
| Gustina | 1,007 g/cm3 | ||
| Tačka topljenja | −5 °C (23 °F; 268 K) | ||
| Tačka ključanja | 129 °C (264 °F; 402 K) | ||
| meša se | |||
| Kiselost (pKa) | 8.36[1] | ||
| Opasnosti | |||
| Opasnost u toku rada | Zapaljiv, korozivan | ||
| Bezbednost prilikom rukovanja | Oxford MSDS | ||
| R-oznake | R10 R20/21/22 R34 | ||
| S-oznake | (S1/2) S23 S36 S45 | ||
| NFPA 704 | |||
| Tačka paljenja | 31 °C | ||
| 275 °C (527 °F; 548 K) | |||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Proizvodnja
уредиMorfolin se može proizvoditi dehidratacijom dietanolamina sumpornom kiselinom:[3]
Upotreba
уредиIndustrijske primene
уредиMorfolin se često koristi kao aditiv, u malim (delovi na milion) koncentracijama, za pH podešavanje u parnim sistemima fosilnih i nuklearnih elektrana. Morfolin se koristi zato što je njegova isparljivost približno ista sa vodom, tako da kad je dodat u vodu njegova koncentracija je ravnomerno raspoređena između tečne i gasovite faze. Usled toga on ravnomerno podešava pH vrednosti u celoj parnoj instalaciji, čime se sprečava korozija. Morfolin se često koristi zajedno sa niskim koncentracijama hidrazina ili amonijaka kao sredstvo za sveobuhvatani hemijski treatman protiv korozije za parne sisteme takvih postrojenja. Morfolin se sporo razlaže u odsustvu kiseonika na visokim temperaturama i pritisku tih sistema.
Organska sinteza
уредиMorfolin podleže većini hemijskih reakcija tipičnih za druge sekundarne amine, mada usled prisustva etarskog kiseonika dolazi do smanjenja elektronske gustine na atomu azota, zbog čega je on manje nukleofilan (i manje bazan) nego strukturno slični sekundarni amini, kao što je piperidin. Iz tog razloga, on formira stabilni hloramin.[4]
On se često koristi za generisanje enamina.[5]
Morfolin je u širokoj upotrebi u organskoj sintezi. Na primer, on je gradivni blok u pripremi antibiotika linezolida i antitumorskog leka gefitiniba (Iressa).
U naučnim istraživanjima i industriji, morfolin je zbog svoje niske cene i polarnost uobičajeni rastvarač za hemijske reakcije.
Reference
уреди- ^ Hall, H.K., J. Am. Chem. Soc., 1957, 79, 5441.
- ^ National Institute for Occupational Safety and Health (2000). „Morpholine”. International Chemical Safety Cards. Архивирано из оригинала 25. 12. 2007. г. Приступљено 5. 11. 2005.
- ^ Klaus Weissermel; Hans-Jürgen Arpe; Charlet R. Lindley; Stephen Hawkins (2003). „Chap. 7. Oxidation Products of Ethylene”. Industrial Organic Chemistry. Wiley-VCH. стр. 159—161. ISBN 978-3-527-30578-0.
- ^ Lindsay Smith, J. R.; McKeer, L. C.; Taylor, J. M. (1993). „4-Chlorination of Electron-Rich Benzenoid Compounds: 2,4-Dichloromethoxybenzene”. Org. Synth.; Coll. Vol., 8, стр. 167
- ^ Noyori, R.; Yokoyama, K.; Hayakawa, Y. (1988). „Cyclopentenones from α,α'-Dibromoketones and Enamines: 2,5-Dimethyl-3-Phenyl-2-Cyclopenten-1-one”. Org. Synth.; Coll. Vol., 6, стр. 520
Literatura
уреди- Klaus Weissermel; Hans-Jürgen Arpe; Charlet R. Lindley; Stephen Hawkins (2003). „Chap. 7. Oxidation Products of Ethylene”. Industrial Organic Chemistry. Wiley-VCH. стр. 159—161. ISBN 978-3-527-30578-0.