„Molekular“ – Versionsunterschied
| [ungesichtete Version] | [gesichtete Version] |
Keine Bearbeitungszusammenfassung |
⚙️ Bot: Quelltextbereinigung, prüfe und aktualisiere Vorlagen-Einbindungen |
||
| (37 dazwischenliegende Versionen von 28 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| ⚫ | Ein Vorgang in den [[Naturwissenschaft]]en ist '''molekular''' ([[Latein|lat.]] ''{{lang|la|molecula}}'', [[Diminutiv]] von ''{{lang|la|moles}}'' ‚Masse‘), wenn er die Ebene der [[Molekül]]e oder die Moleküle selbst betrifft. Im übertragenen Sinne wird damit oft auch von Vorgängen gesprochen, die sich auf sehr kleine Teilchen beziehen. |
||
| ⚫ | |||
| ⚫ | Ein Vorgang in den [[Naturwissenschaft]]en ist '''molekular''' ( |
||
== Molekulare Elemente == |
|||
| ⚫ | |||
In der [[Chemie]] bedeutet ''molekular'' auch, dass ein [[chemisches Element]] in Form mehratomiger Moleküle vorliegt. Beispiele sind [[Dimer]]e, also [[biatomar]]e Verbindungen wie [[Sauerstoff]] O<sub>2</sub>, [[Stickstoff]] N<sub>2</sub>, [[Wasserstoff]] H<sub>2</sub> und die [[Halogene]] F<sub>2</sub>, Cl<sub>2</sub> sowie Moleküle aus mehreren, gleichen Atomen wie [[Ozon]] O<sub>3</sub>, [[Phosphor]] P<sub>4</sub> und Schwefel S<sub>8</sub>. Der Gegensatz dazu sind [[atomar]] vorkommende Elemente, etwa die [[Edelgase]]. |
|||
| ⚫ | |||
== Intermolekular == |
|||
| ⚫ | Mit '''intermolekular''' (von [[Latein|lateinisch]] ''inter'', ‚dazwischen‘) bezeichnet man in [[Chemie]] und [[Physik]] einen Vorgang (wie beispielsweise eine chemische Reaktion), der ''zwischen'' zwei oder mehreren verschiedenen Molekülen abläuft.<ref>{{RömppOnline|ID=RD-09-00911|Name=Intermolekular|Abruf=2015-09-22}}</ref> |
||
Beispiele für solche Vorgänge sind: |
Beispiele für solche Vorgänge sind: |
||
*die meisten [[Chemische Reaktion|Chemischen Reaktionen]], |
* die meisten [[Chemische Reaktion|Chemischen Reaktionen]], |
||
*Intermolukulare [[Wasserstoffbrückenbindung]]en (siehe [[Quartärstruktur]] der [[Protein]]e). |
* Intermolukulare [[Wasserstoffbrückenbindung]]en (siehe [[Quartärstruktur]] der [[Protein]]e). |
||
[[Datei:Essigsäureanhydrid Herstellung.svg|mini|hochkant=2.5|zentriert|Dehydratisierung von Essigsäure zu Essigsäureanhydrid – eine intermolekulare Reaktion.]] |
|||
| ⚫ | |||
== Intramolekular == |
|||
| ⚫ | |||
[[Datei:Synthesis of Phthalic Anhydride V2.svg|mini|Synthese von Phthalsäureanhydrid, eine intramolekulare Reaktion]] |
|||
| ⚫ | |||
Mit '''intramolekular''' (von [[Latein|lateinisch]] ''intra'' |
Mit '''intramolekular''' (von [[Latein|lateinisch]] ''intra'', ‚innerhalb‘) bezeichnet man hingegen einen Vorgang, der ''innerhalb'' eines einzelnen [[Molekül]]s abläuft.<ref>{{RömppOnline|ID=RD-09-01019|Name=Intramolekular|Abruf=2015-09-22}}</ref> |
||
Beispiele für solche Vorgänge sind: |
Beispiele für solche Vorgänge sind: |
||
* Aufspaltung eines Moleküls in seine Atome (siehe z. |
* Aufspaltung eines Moleküls in seine Atome (siehe z. B. [[Wasserstoff#Atomarer Wasserstoff|Wasserstoff]]), |
||
* Intramolekulare [[Säureanhydrid|Anhydrid]]bildung (siehe [[Phthalsäureanhydrid]]), |
* Intramolekulare [[Säureanhydrid|Anhydrid]]bildung (siehe [[Phthalsäureanhydrid]]), |
||
* Intramolekulare [[Redoxreaktion]], z. B. siehe Bildung von Lachgas ([[Distickstoffmonoxid]] N<sub>2</sub>O) aus [[Ammoniumnitrat]], oder Explosion von Ammoniumnitrat bei [[Initialzündung]] |
|||
* Intramolekulare [[Ester]] (siehe [[Lactone]]), |
|||
* Intramolekulare [[Carbonsäureester]] ([[Lactone]]) oder [[Carbonsäureamide]] ([[Lactame]]), |
|||
* Intramolekulare [[Wasserstoffbrückenbindung]]en (siehe [[Protein]]e). |
* Intramolekulare [[Wasserstoffbrückenbindung]]en (siehe [[Protein]]e). |
||
Bei den |
Bei den [[Proteine]]n und anderen [[Makromolekül]]en wie [[Nukleinsäuren]] ([[DNA]], [[RNA]]) oder [[Polysaccharide]]n sind die intramolekularen Wechselwirkungen durch [[Sekundärstruktur|Sekundär-]] und [[Tertiärstruktur]] Ursache für die räumliche Gestalt der Moleküle. |
||
== Siehe auch == |
|||
| ⚫ | |||
| ⚫ | |||
== |
== Weblinks == |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
== Einzelnachweise == |
|||
==Weblinks== |
|||
<references /> |
|||
*{{Wiktionary|intermolekular}} |
|||
*{{Wiktionary|intramolekular}} |
|||
[[Kategorie:Physik]] |
|||
[[Kategorie:Chemie]] |
[[Kategorie:Chemie]] |
||
[[Kategorie:Naturwissenschaft]] |
|||
Version vom 26. Mai 2021, 17:45 Uhr
Ein Vorgang in den Naturwissenschaften ist molekular (lat. molecula, Diminutiv von moles ‚Masse‘), wenn er die Ebene der Moleküle oder die Moleküle selbst betrifft. Im übertragenen Sinne wird damit oft auch von Vorgängen gesprochen, die sich auf sehr kleine Teilchen beziehen.
Molekulare Elemente
In der Chemie bedeutet molekular auch, dass ein chemisches Element in Form mehratomiger Moleküle vorliegt. Beispiele sind Dimere, also biatomare Verbindungen wie Sauerstoff O2, Stickstoff N2, Wasserstoff H2 und die Halogene F2, Cl2 sowie Moleküle aus mehreren, gleichen Atomen wie Ozon O3, Phosphor P4 und Schwefel S8. Der Gegensatz dazu sind atomar vorkommende Elemente, etwa die Edelgase.
Intermolekular
Mit intermolekular (von lateinisch inter, ‚dazwischen‘) bezeichnet man in Chemie und Physik einen Vorgang (wie beispielsweise eine chemische Reaktion), der zwischen zwei oder mehreren verschiedenen Molekülen abläuft.[1]
Beispiele für solche Vorgänge sind:
- die meisten Chemischen Reaktionen,
- Intermolukulare Wasserstoffbrückenbindungen (siehe Quartärstruktur der Proteine).

Bei chemischen Verbindungen bestimmen die intermolekularen Wechselwirkungen zwischen den einzelnen Molekülen viele makroskopische Eigenschaften, wie zum Beispiel Schmelzpunkt, Siedepunkt, Härte, Löslichkeit usw.
Intramolekular
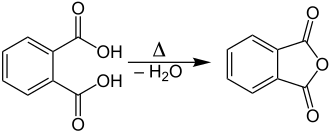
Mit intramolekular (von lateinisch intra, ‚innerhalb‘) bezeichnet man hingegen einen Vorgang, der innerhalb eines einzelnen Moleküls abläuft.[2]
Beispiele für solche Vorgänge sind:
- Aufspaltung eines Moleküls in seine Atome (siehe z. B. Wasserstoff),
- Intramolekulare Anhydridbildung (siehe Phthalsäureanhydrid),
- Intramolekulare Redoxreaktion, z. B. siehe Bildung von Lachgas (Distickstoffmonoxid N2O) aus Ammoniumnitrat, oder Explosion von Ammoniumnitrat bei Initialzündung
- Intramolekulare Carbonsäureester (Lactone) oder Carbonsäureamide (Lactame),
- Intramolekulare Wasserstoffbrückenbindungen (siehe Proteine).
Bei den Proteinen und anderen Makromolekülen wie Nukleinsäuren (DNA, RNA) oder Polysacchariden sind die intramolekularen Wechselwirkungen durch Sekundär- und Tertiärstruktur Ursache für die räumliche Gestalt der Moleküle.
Siehe auch
Weblinks
Einzelnachweise
- ↑ Eintrag zu Intermolekular. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. September 2015.
- ↑ Eintrag zu Intramolekular. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. September 2015.