Telómero
Los telómeros (del griego τέλος [telos], «final», y μέρος [meros], «parte») son los extremos de los cromosomas. Son regiones de ADN no codificante, altamente repetitivas, cuya función principal es la estabilidad estructural de los cromosomas en las células eucariotas, la división celular y el tiempo de vida de las estirpes celulares. Además están involucrados en enfermedades tan importantes como el cáncer.
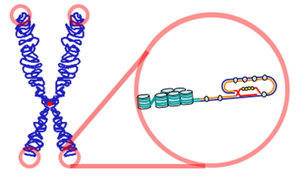
Los organismos procariotas tienen cromosomas circulares que no poseen telómeros. Algunos procariotas poseen cromosomas lineales con secuencias teloméricas, cuya secuencia es diferente a la de los eucariotas.
Descubrimiento de los telómeros
editarA principios de la década de 1970, el teórico ruso Alexei Olovnikov reconoció por primera vez que los cromosomas no podían replicar completamente sus extremos. Basándose en esto, y para acomodar la idea de Leonard Hayflick de división celular somática limitada, Olovnikov sugirió que las secuencias de ADN se pierden cada vez que una célula se replica hasta que la pérdida alcanza un nivel crítico, momento en el que termina la división celular.
Los científicos Elizabeth H. Blackburn, Carol W. Greider y Jack W. Szostak son reconocidos con el Premio Nobel de medicina en 2009 por la descripción molecular de los telómeros, la demostración de su conservación evolutiva y el descubrimiento de la telomerasa, enzima central de la maquinaria celular para la síntesis del telómero, por haber logrado un muy consistente modelo que explica el 'problema de la terminación de la replicación' (end-replication problem) y el mecanismo molecular de protección de los extremos cromosomales.
En 1983, Barbara McClintock recibió el Premio Nobel. Desde entonces, se ha avanzado mucho en el conocimiento de los telómeros, gracias a las técnicas de genética molecular. Proponían que los telómeros, situados en los extremos de los cromosomas, tenían la función de prevenir que éstos se fusionaran al ponerse en contacto por sus extremos, lo que produciría consecuencias desastrosas para las células.
Consideraciones generales
editarEn los cromosomas existen dos tipos de ADN: el ADN codificante, que constituye los genes, es decir, porciones del cromosoma donde se encuentra la información que codifica las proteínas, el Ácido ribonucleico de transferencia y los ácidos ribonucleicos ribosomales, disperso entre una gran cantidad de ADN no codificante. Entre el ADN no codificante se encuentran el que forma el centrómero y los telómeros de los cromosomas. El centrómero es una porción alargada de ADN que permite que la molécula del ADN se fije al huso mitótico durante la fase M del ciclo celular. Por su parte, los telómeros juegan un importante papel en la vida de las células ya que mantienen la integridad de las terminaciones de los cromosomas impidiendo que se enmarañen y adhieran unos con otros, ayudan a que los cromosomas homólogos se emparejen y entrecrucen durante la profase de la meiosis. Los telómeros humanos y murinos[cita requerida] contienen hasta 2000 veces repetida la secuencia 5' TTAGGG 3':
5'...TTAGGG TTAGGG TTAGGG TTAGGG TTAGGG TTAGGG..3'
3'...AATCCC AATCCC AATCCC AATCCC AATCCC AATCCC..5'
Envejecimiento y carcinogénesis
editarAlgunas teorías del envejecimiento y de la carcinogénesis se basan en que los telómeros son como los relojes o temporizadores de la célula, ya que marcan el número de divisiones celulares, hasta que la célula muere. Los fundamentos de estas teorías son:
- El ADN contenido en los telómeros no se replica completamente durante la duplicación del ADN, ya que los enzimas ADN polimerasa solo pueden trabajar en dirección 5'->3'. Para una de las dos hebras (conductora) esto no supone problema, pero para poder duplicar simultáneamente la hebra retrasada (que se presenta en dirección 3'->5') deben formarse los fragmentos de Okazaki. El inicio de cada segmento está constituido por un primer de ARN. Estos son finalmente sustituidos por ADN, sin embargo, el primer del extremo 5' de la hebra no puede ser completado, ya que se requeriría trabajar en dirección 3'->5'. Como consecuencia, el telómero que se va haciendo cada vez más y más corto en cada replicación.
- Los telómeros, en la mayoría de las especies animales y vegetales y en los microorganismos, están constituidos por subunidades cortas de nucleótidos generalmente ricos en timina (T) y guanina (G). En los humanos la secuencia de cada una de estas subunidades es TTAGGG.
- El número de repeticiones es variable según las distintas células de un mismo individuo; sin embargo el promedio de repeticiones suele ser constante para cada especie. En una persona se calcula que alcanza aproximadamente las 2000 repeticiones. Según Consulosky Slater.[cita requerida]
- La telomerasa es una enzima formada por un complejo proteína-ácido ribonucleico con actividad transcripatasa inversa (es decir, puede sintetizar ADN a partir de una secuencia de ARN que ella misma porta), que es producida en células germinales embrionarias que permite el alargamiento de los telómeros.
- La telomerasa es reprimida en las células somáticas maduras después del nacimiento, lo que producen un acortamiento del telómero después de cada división celular.
- Cuando la longitud del telómero alcanza cierto límite, se interrumpen las mitosis quedando las células en el estadio G0 (G Cero) de su ciclo celular.
- El desgaste del telómero en el transcurso de ciclos celulares, impide su función protectora del cromosoma, con lo que este se vuelve inestable, se fusiona o se pierde. Las células que presentan estos defectos, no sólo son incapaces de duplicarse, sino que dejan de ser viables y se activan los procesos de apoptosis o muerte celular programada.
- Muchas células cancerosas reactivan la actividad de telomerasa, favoreciendo la proliferación de un clon maligno. Se están estudiando fármacos que inhiben la telomerasa y así detener el crecimiento de las células malignas, por lo que podría ser una nueva diana terapéutica del cáncer[cita requerida].
Especialistas del Centro Nacional de Investigaciones Oncológicas (CNIO), han desarrollado un tratamiento que actúa sobre los genes que, aplicado en animales adultos, una única vez, consigue de manera segura alargar la vida media de los individuos. Este tipo de investigaciones obligaba a modificar permanentemente los genes de los animales desde la fase embrionaria. Sin embargo, la terapia génica desarrollada por el CNIO para combatir el envejecimiento ha sido probada en ratones adultos de uno y dos años, y tuvo un efecto "rejuvenecedor" sobre ellos.
El procedimiento consiste en tratar modificar la carga genética de un virus cuyo ADN ha sido modificado; sus genes se sustituyen por uno de los genes más importantes para el envejecimiento de las especies tratadas: el que codifica la enzima telomerasa. La telomerasa frena este efecto, reconstruye los telómeros y corrige el reloj biológico de la célula. El virus con el ADN tratado e inoculado en el animal actúa como un vehículo que deposita el gen de la telomerasa en las células.[1]
La replicación de los cromosomas lineales plantea un problema
editarLa ADN polimerasa sólo puede fabricar nuevas hebras de ADN cuando se mueve a lo largo de la cadena molde, polimerizando nucléotidos en la dirección 5' → 3' (sobre una hebra molde de polaridad 3' → 5'). Esto no plantea ningún problema para la hebra denominada "contínua" de un cromosoma, dado que la polimerasa se puede mover libre e ininterrumpidamente desde del origen de replicación hasta el final del cromosoma o hasta que encuentra una señal de terminación. No ocurre lo mismo cuando la hebra molde es la de direccionalidad 5´ → 3' cuya replicación debe ser forzosamente discontinua, dado que el complejo de replicación se mueve coordinadamente sobre las dos hebras parentales, de direccionalidades opuestas. Cuando la horquilla de replicación se ha abierto lo suficiente, la ADN-polimerasa sintetiza un fragmento del ADN complementario en el sentido contrario al del avance del complejo de replicación. Luego de formarse este fragmento, la síntesis de un nuevo cebador da comienzo a la polimerización de un nuevo fragmento, y así sucesivamente. Más tarde, estos fragmentos de ADN (llamados fragmentos de Okazaki) serán empalmados mediante una ligasa.
Sin embargo, al llegar al final del cromosoma, el último fragmento de Okazaki queda a una distancia del extremo de su hebra molde que resulta insuficiente para el agregado de un nuevo cebador. Por esta razón, la cadena discontinua no se puede completar y se produce un acortamiento asimétrico (es decir, sólo en la hebra hija) del telómero. Durante cada replicación, el proceso se repite, acortando progresivamente los telómeros en ambos extremos del cromosoma. Se estima que las células humanas pierden unos 100 pares de bases de ADN telomérico en cada replicación. Esto representa unos 16 fragmentos TTAGGG. Teniendo en cuenta el número inicial de estas secuencias, al cabo de unas 125 divisiones mitóticas, el telómero se ha perdido completamente
La pregunta es: ¿es debido a esto que en las células somáticas, después de un número determinado de divisiones, la célula muere?
Los experimentos de Hayflick mostraron que las células normales (no cancerosas) no crecen in vitro de forma indefinida pese a suministrarle todos los nutrientes y factores de crecimiento necesarios. Las células obtenidas de recién nacidos cultivadas in vitro experimentan unas 100 divisiones, mientras que células obtenidas de sujetos mayores, solo se dividen unas 20 a 24 veces.[2] ¿Es esto debido a los telómeros que representan como un reloj que determina la longevidad de las células?
A favor de esta hipótesis está el hecho de que algunas células son inmortales, como las células germinales, las células eucariotas unicelulares (como el Paramecium) o algunas células tumorales. En todas ellas existe una enzima, denominada telomerasa que después de cada división reinstaura la integridad de los telómeros.
La telomerasa (TERT)
editarLa telomerasa es una transcriptasa inversa que sintetiza ADN a partir de un molde de ARN. Se trata de una ribonucleoproteína que contiene en su molécula la secuencia AAUCCC capaz de crear e insertar los fragmentos TTAGGG que se pierden en cada división. En 1998, Bodnar y col introdujeron en dos tipos de células humanas normales, telomerasa-negativas, el gen que codifica la telomerasa. En contraste con las células normales que mostraban senescencia y un acortamiento de los telómeros, los clones expresando la TERT mostraron telómeros elongados, se dividían vigorosamente y mostraron una reducción de la beta-galactosidasa, un biomarcador de la senescencia. Las células transformadas para expresar la TERT mostraron un cariotipo normal y su longevidad ha superado la normal en más de 20 divisiones.
Muchas células cancerosas derivan de células somáticas, y se ha comprobado la presencia de telomerasa en el 75-80% de las líneas tumorales. Esto no quiere decir que la telomerasa induzca el cáncer. Es más, Kathleen Collins de la Universidad de Califormia en Berkeley,[cita requerida] encontró que pacientes con una enfermedad congénita muy poco frecuente, la disqueratosis congénita, tenían niveles de telomerasa anormalmente bajos, muriendo no obstante en muchos casos de cáncer gastrointestinal. A pesar de esta incongruencia, se sabe que la agresividad de las células tumorales está relacionada con sus niveles de telomerasa y que niveles altos de esta enzima son indicativos de la malignidad del tumor. Recientemente la FDA ha autorizado dos estudios clínicos con telomerasa, uno de ellos encaminado a obtener un mejor diagnóstico del cáncer cervical y el otro para evaluar un fármaco contra la leucemia mieloide.[cita requerida]
En Japón está siendo utilizada en niños con neuroblastoma 4S. Al parecer estos niños tienen un cáncer metastásico, pero los tumores son telomerasa negativos y aproximadamente el 80% llegan a una remisión espontánea una vez que el tumor ha sido eliminado quirúrgicamente. El estudio identifica los que son telomerasa-positivos, de manera que puedan ser tratados de una manera más agresiva.
Algunas secuencias conocidas de telómeros
editar| Grupo | Organismo | Secuencia del telómero (Dirección 5'a 3' hasta el fin) |
|---|---|---|
| Protozoos ciliados | Tetrahymena, Glaucoma Paramecium Oxytricha, Stylonychia, Euplotes |
TTGGGG TTGGG(T/G) TTTTGGGG |
| Protozoos apicomplejos | Plasmodium | TTAGGG(T/C) |
| Plantas superiores | Arabidopsis thaliana | TTTAGGG |
| Algas verdes | Chlamydomonas | TTTTAGGG |
| Protozoos cinetoplástidos | Trypanosoma, Crithidia | TTAGGG |
| Mohos del fango | Physarum, Didymium Dictyostelium |
TTAGGG AG(1-8) |
| Hongos filamentosos | Neurospora crassa | TTAGGG |
| Vertebrados | Humanos, ratón, Xenopus | TTAGGG |
| Ascáridos | Ascaris lumbricoides | TTAGGC |
| Insectos | Bombyx mori | TTAGG |
| Levaduras aisladas | Schizosaccharomyces pombe | TTAC(A)(C)G(1-8) |
| Levaduras agregadas | Saccharomyces cerevisiae Candida glabrata |
TGTGGGTGTGGTG (de copias de ARN) or G(2-3)(TG)(1-6)T (consenso) |
Véase también
editarCitas
editar- ↑ EMBO Molecular Medicine. Bruno Bernardes de Jesús, Elsa Vera, Kerstin Schneeberger, Águeda M. Tejera, Eduard Ayuso, Fátima Bosch, Maria A. Blasco. Telomerase gene therapy in adult and old mice delays aging and increases longevity without increasing cancer. Artículo publicado online: 15 MAY 2012 Consultado: 20/06/2.012
- ↑ Hayflick, L.; Moorhead, P.S. (1961), «The serial cultivation of human diploid cell strains», Exp cell res 25 (3): 585--621, consultado el 26 de enero de 2010.
Referencias
editar- Blackburn, E. H. 1991. Structure and function of telomeres. Nature 350:569-72.
- Witzany, G. 2008. The Viral Origins of Telomeres and Telomerases and their Important Role in Eukaryogenesis and Genome Maintenance. Biosemiotics 1: 191-206.
- Toftgård, Rune. 2009. Maintenance of chromosomes by telomeres and the enzyme telomerase.The Nobel Assembly at Karolinska Institutet - The Nobel Prize in Physiology or Medicine [1]
Enlaces externos
editar- Life Length: empresa spin-off del Centro Nacional de Investigaciones Oncológicas (CNIO) basada en Madrid que brinda servicios de medición de telomeros fundada por María Blasco, Stephen Matlin y la Fundación Botín