Estructura primaria de las proteínas

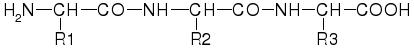
La estructura primaria es la secuencia de aminoácidos de una cadena polipeptídica.[1] Esta secuencia se escribe desde el grupo amino-terminal hasta el carboxi-terminal, de acuerdo con el orden en que se sintetizan las proteínas por el ribosoma. Los aminoácidos están unidos de manera covalente por medio de enlaces peptídicos. Debido a que la formación del enlace peptídico ocurre por una reacción de condensación, se desprende una molécula de agua, producto del -OH del carboxilo y de un -H del grupo amino, y se habla propiamente de la secuencia de residuos de aminoácidos (o simplemente residuos).La cadena principal está formada por la sucesión de enlaces peptídicos que forma una columna vertebral de la cadena polipeptídica. El primer residuo tiene su grupo α-NH2 libre y el último residuo tiene su grupo α-COOH libre. Así se establecen el extremo N-terminal y C-terminal, con el que inicia y termina la secuencia de residuos.
La forma de plegamiento, y por lo tanto la función de la cadena polipeptídica está determinada por la secuencia de los residuos. La secuencia de aminoácidos determina los otros niveles estructurales y las propiedades de cada polipéptido, debido a que las cadenas laterales de cada aminoácido presentan propiedades físico-químicas particulares. Por ello, los aminoácidos interactúan por fuerzas de atracción intermoleculares diversas con el agua, los compuestos hidrofóbicos y las cadenas laterales de aminoácidos cercanos.
La estructura primaria constituye la forma más básica para describir a las proteínas. Los otros niveles de estructura de las proteínas son la estructura secundaria y la estructura terciaria. La asociación de varias cadenas polipeptídicas que resulta en una proteína funcional origina un nivel superior de organización, la llamada estructura cuaternaria.
Cuando una proteína se somete a hidrólisis quedan en libertad los aminoácidos que constituyen a este, los cuales pueden ser identificados en una cantidad determinada.[2]
Entre la estructura primaria y la forma tridimensional de las proteínas
[editar]La secuencia de aminoácidos de una cadena polipeptídica determina el tipo de interacciones no covalentes que se producirán (tanto entre la misma proteína como con su entorno) y el grado de libertad de adoptar diferentes conformaciones estables a una temperatura fisiológica. Algunos efectos de determinados aminoácidos sobre la estructura de la cadena son:
- aminoácidos hidrófobos alifáticos (Alanina (Ala), Valina (Val), Isoleucina (Ile), Leucina (Leu)): Se encuentran en la región interna de las proteínas o, en el caso de las proteínas de membrana, interaccionando con las colas hidrofóbicas de los ácidos grasos. También pueden mantener unidas a proteínas en forma reversible y permitir la unión con sustratos hidrófobos en enzimas (P.Ej: la unión de fosfolipasas (PL) con su sustrato, los fosfolípidos de las membranas, es estabilizada mediante la interacción de aminoácidos hidrófobos con las colas hidrofóbicas de los ácidos grasos.). Algunas estructuras proteicas formadas por aminoácidos hidrófobos son las cremalleras de leucina, bolsillos hidrófobos, alfa hélices hidrófobas.
- aminoácidos hidrófobos aromáticos (Fenilalanina (Phe), Tirosina (Tyr), Triptófano (Trp)): Al igual que los aminoácidos hidrófobos alifáticos suelen encontrarse en la proteína en regiones donde no se encuentran en contacto con el agua. En el caso de la tirosina y el triptófano, como tienen un grupo polar en su cadena lateral, podrían presentar cierta interacción con sustancias polares.
- aminoácidos polares sin carga neta (Treonina (Thr), Serina (Ser), Asparagina (Asn), Glutamina (Gln)), ácidos (Aspartato (Asp), Glutamato (Glu)) y básicos (Histidina (His), Lisina (Lys), Arginina (Arg)): Están ubicados en la superficie proteica en contacto con el agua, iones y otras moléculas polares. Se encuentran en la superficie de los orificios en las proteínas de membrana formando canales iónicos y de otras moléculas polares. Posibilitan la solubilidad de la proteína en el medio acuoso.
- Cisteína (Cys): Es un aminoácido azufrado que puede oxidarse para formar puentes disulfuro (-S-S-) con una segunda cisteína ubicada en la misma cadena polipepídica o en una cadena diferente. Esto le da a la estructura de la proteína una mayor estabilidad limitando su deformación.
- Glicina (Gly): Por el pequeño tamaño de su residuo lateral puede ubicarse en lugares muy estrechos dentro de la proteína, permitiéndole una forma más compacta. En ciertas estructuras como las hélices puede ser un factor desestabilizante debido a que permite una mayor libertad de movimiento.
- Prolina (Pro): Por su estructura cíclica, permite cambios bruscos en la dirección de la cadena polipeptídica y limita la posibilidad de movimiento aleatorio de la cadena. Se encuentra en estructuras como los giros beta y giros gamma.
Modificaciones postraduccionales
[editar]Algunos residuos laterales de aminoácidos en ciertas proteínas son modificados luego de la traducción por acetilación, metilación, carboxilación, Hidroxilación, Glucosilación y Fosforilación, entre otros, cambiándose las propiedades electrónicas de los mismos. Algunos ejemplos son:
Por qué conocer la estructura primaria de las proteínas
[editar]Conocer la estructura primaria de una proteína es importante para entender su función (ya que ésta depende de la secuencia de aminoácidos y de la forma que adopte), así como en el estudio de enfermedades genéticas. Es posible que el origen de una enfermedad genética radique en una secuencia anormal. Esta anomalía, si es severa, podría resultar en que la función de la proteína no se ejecute de manera adecuada o, incluso, que no se ejecute en lo absoluto.
A su vez, el estudio comparativo de la estructura primaria de las proteínas en organismos de diferentes especie, permite identificar patrones evolutivos a nivel molecular.[3] Las diferencias entre las secuencias de una dos o más proteínas que tienen funciones idénticas o similares pueden ser producto de la selección natural o de otros mecanismos evolutivos (como la deriva génica o evolución neutralista). Por otro lado, las secuencias conservadas usualmente corresponden con regiones estructural o funcionalmente esenciales para la función biológica de dichas proteínas. A partir de estos estudios, se establecen familias de proteínas.
Deducción de la estructura primaria
[editar]La secuencia de aminoácidos está especificada en el ADN por la secuencia de nucleótidos. Existe un sistema de conversión, llamado código genético, que se utiliza para deducir la secuencia de aminoácidos de una cadena polipeptídica a partir de la secuencia de nucleótidos del gen. Sin embargo, ciertas modificaciones durante la transcripción del ADN, producidas por el splicing o corte y empalme alternativo no siempre permiten que esta conversión pueda hacerse directamente.
Para obtener la secuencia de aminoácidos a partir de una muestra purificada de proteína, se recurre a métodos como la técnica de secuenciación a partir del N-terminal por degradación de Edman, o la fragmentación de la cadena en péptidos pequeños y su posterior identificación por espectrometría de masas.
Efecto de las mutaciones genéticas sobre la estructura primaria de las proteínas
[editar]Las mutaciones genéticas de tipo puntual pueden alterar la secuencia de aminoácidos de la cadena polipeptídica. Estas modificaciones pueden producir:
- cambios conservadores: en los cuales la naturaleza de la cadena lateral es mantenida (Ej: si es reemplazado un residuo de Asparagina por uno de Glutamina); en este caso, los cambios en la estructura y función proteica no son tan significativos.
- cambios no conservadores: donde la mutación reemplaza el aminoácido por otro de propiedades diferentes (Ej: se reemplaza un residuo de Arginina por otro de Prolina). Este último tipo de cambios en la cadena peptídica puede llegar a alterar la función de la proteína y si ocurren en células sexuales pueden llegar a perpetuarse en futuras generaciones, siendo un factor muy importante en los procesos evolutivos.
- no hay cambio: las mutaciones silenciosas o sinónima en el gen producen la misma secuencia de aminoácidos. Esto se debe a que el código genético es degenerado, es decir, contiene codones que son redundantes. Por ejemplo, el aminoácido glicina, tiene cuatro codones: GGA, GGU, GGG y GGC, lo que significa que si ocurre una mutación que altere el nucleótido de la tercera posición, el aminoácido que se incorpore en la proteína siempre va a ser glicina.
Otro tipo de mutaciones, como la deleción, inserción, duplicación, e inversión producen generalmente proteínas alteradas en el tamaño (más grande o menor, dependiendo la región del gen donde ocurrió la mutación) o la estructura tridimensional o ambos. En casi todos estos casos, las proteínas aberrantes conducen a problemas fisiológicos severos.
Véase también
[editar]- Estructura secundaria de las proteínas
- Estructura terciaria de las proteínas
- Estructura cuaternaria de las proteínas
Referencias
[editar]- ↑ Watson, James D., 1928-. Molecular biology of the gene (Seventh edition edición). ISBN 978-0-321-76243-6. OCLC 824087979. Consultado el 7 de abril de 2020.
- ↑ Blanco-Blanco, Química Biologica (2012). «3». Proteínas-Estructura Primaria. San Martín-Mendoza-Argentina: El Ateneo. p. 37. ISBN 978-950-02-0575-7.
- ↑ «PDB101: Molecule of the Month: Globin Evolution». RCSB: PDB-101. doi:10.2210/rcsb_pdb/mom_2017_2. Consultado el 8 de abril de 2020.
Bibliografía
[editar]- C. Mathews, K. E. Van Holde, K. Ahern. 2003. Bioquímica (3ªEd.).Addisson Wesley.
- Lodish y col. 2005. Biología celular y molecular (5ªEd.).Editorial Médica Panamericana.